もくじ
第1問
問1 正解 2
1 〇 同じ元素でも同位体はそれぞれ中性子の数が異なるので、質量数も違います。
2 × 同位体は原子番号が同じ(つまり陽子の数が同じ)で、中性子の数が異なる原子同士のことをいいます。陽子の数が同じなので、電子の数も同じです。
3 〇 同位体は同じ元素のうち、中性子の数が異なる原子のことを指します。
4 〇 原子量は、その元素のすべての同位体を集めたときの平均の質量です。
例えば塩素原子 Cl は、質量数 35(相対質量 34.97) の存在比が約 76 %、質量数 37(相対質量 36.97)の存在比が約 24 %なので、
原子量 = 34.97 × 約0.76 + 36.97 × 約0.24 ≒ 35.45
となります。周期表で確かめても、Cl の原子量は35.452と書かれています。
5 〇 ある元素の同位体が不安定であるために、原子核が崩壊しながら放射線を放出するものを放射性同位体といいます。
質量数 3 の水素原子や、質量数 14 の炭素原子が放射性同位体です。
問2 正解 a 4 b 1
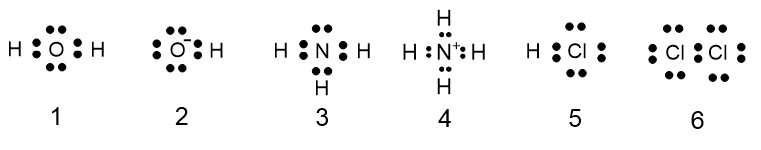
上図は①から⑥の電子式です。
図の通り、
① 共有電子対 2 個と非共有電子対 2 個
② 共有電子対 1 個と非共有電子対 3 個
③ 共有電子対 3 個と非共有電子対 1 個
④ 共有電子対 4 個と非共有電子対 0 個
⑤ 共有電子対 1 個と非共有電子対 3 個
⑥ 共有電子対 1 個と非共有電子対 6 個
となります。
問3 正解 3
1 〇 a は原子番号 3 のリチウム原子 Li です。
電子配置は K 殻に 2 個、L 殻に 1 個です。最外殻の電子数は 1 個です。このように a は 1 族元素であり、アルカリ金属です。
2 〇 b は原子番号 6 の炭素原子 C です。炭素原子の電子配置は K 殻に 2 個、L 殻に 4 個です。最外殻の電子数は 4 個です。このように炭素原子 C は 14 族元素です。
f は原子番号 14 のケイ素原子 Si です。電子配置は K 殻に 2 個、L 殻に 8 個、M 殻に 4 個です。最外殻の電子数は 4 個です。このようにケイ素原子 Si は 14 族元素です。
b の炭素原子と f のケイ素原子は、ともに 14 族元素です。
3 × c は原子番号 9 のフッ素原子 F です。
電子配置は K 殻に 2 個、L 殻に 7 個です。最外殻の電子数は 7 個です。
フッ素原子は電子を失いにくく、イオン化エネルギーは大きいですが、希ガス元素の原子よりはイオン化エネルギーは小さいです。
d は原子番号 10 のネオン原子 Ne で、これは希ガスです。
電子配置は K 殻に 2 個、L 殻に 8 個です。最外殻の電子数は 8 個です。希ガス元素は安定な電子配置なので、電子を失いにくく、イオン化エネルギーは大きくなります。
このように c のフッ素原子のイオン化エネルギーより、d のネオン原子のイオン化エネルギーの方が大きいです。
4 〇 e は原子番号 12 のマグネシウム原子 Mg です。
電子配置は K 殻に 2 個、L 殻に 8 個、M 殻に 2 個です。最外殻の電子数は 2 個です。
f は上で見たように、原子番号 14 のケイ素原子 Si です。
e と f は M 殻まで電子が入っており、第 3 周期の原子です。
5 〇 e は原子番号 12 のマグネシウム原子 Mg です。
e は最外殻電子数 2 個の 2 族元素であり、2 個の電子を失い 2 価の陽イオンになりやすいです。
問4 正解 5
1 〇 分子内に極性があっても、分子全体で極性が打ち消されていれば、無極性分子になります。
例えば、メタン CH4 は C-H 結合で炭素原子 C が負電荷 δ- 、水素原子 H が正電荷 δ+ に偏って極性がありますが、全体では正四面体形となり極性を打ち消しあって無極性分子です。
下の右の図を参照してください。
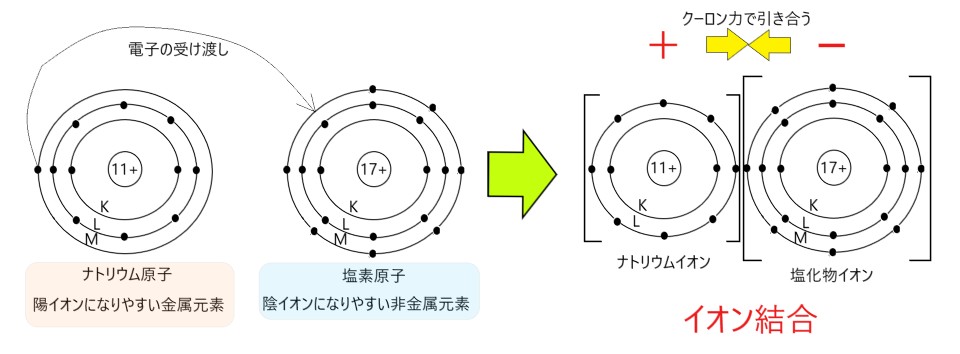
2 〇 イオン結晶は、陽イオンと陰イオンが静電気的な引力(クーロン力)で引き合ってできています。
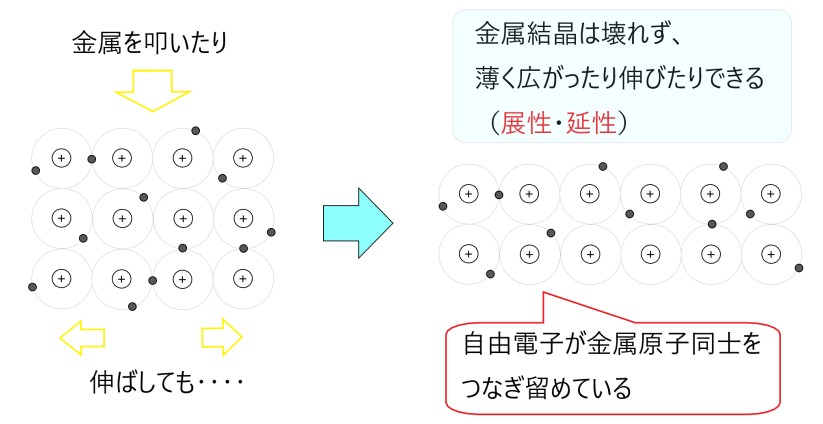
3 〇 金属の自由電子は自由に動けるので、原子核もそれに合わせ結合を保ったまま動くことができ、金属として伸びたり広がったりできます。
4 〇 二つの原子がそれぞれ不対電子を 1 つずつ提供することで、共有結合がつくられます。
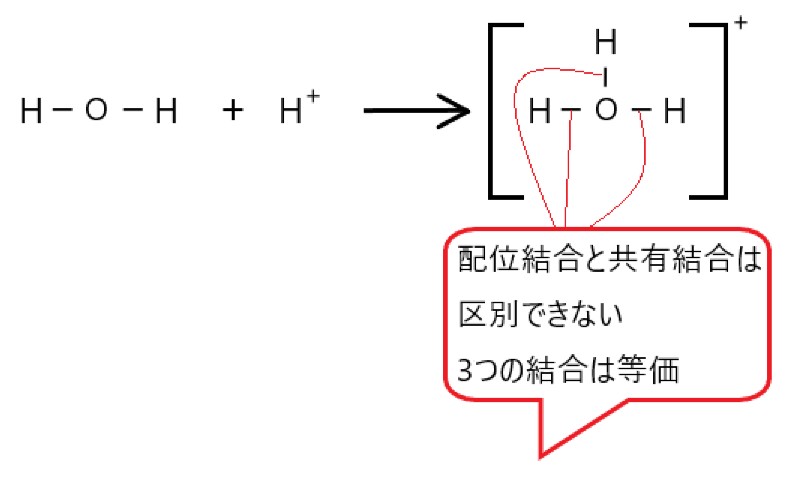
5 × どちらか一方の原子が非共有電子対の 2 個の電子を提供し、つくられた結合でも共有結合になります。これは配位結合と呼ばれます。
配位結合がつくられたあとは、分子内のその他の共有結合と区別できません。
問5 正解 3
2.8 kg の青銅 A にはスズが 2.8 × \(\frac{4.0}{100}\) = 0.112[kg] 含まれます。
1.2 kg の青銅 B にはスズが 1.2 × \(\frac{30}{100}\) = 0.36[kg] 含まれます。
したがって、融解してできた 4.0 kg の青銅 C には、スズが
0.112 + 0.36 = 0.472[kg] = 472[g]
含まれています。
1.0 kg の青銅 C に含まれるスズの物質量は、スズのモル質量が 119 g/mol なので、
472[g] × \(\frac{1.0[kg]}{4.0[kg]}\) × \(\frac{1}{119[g/mol]}\) ≒ 0.99[mol]
問6 正解 7
弱酸の塩の炭酸カルシウムと希塩酸を反応させると、二酸化炭素が発生します。
(炭酸カルシウムは、弱酸の炭酸と強塩基の水酸化カルシウムの塩です。ここでは弱酸の遊離が起こり、炭酸が遊離します。炭酸は水と二酸化炭素に分解します。)
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
ふたまた試験管を使うこの実験では、希塩酸を炭酸カルシウムの試験管に加えたあと、元の方向に戻します。このとき、炭酸カルシウムが希塩酸側の試験管にこぼれないようにくびれを使います。
したがって、炭酸カルシウムはくびれがある側なので、イが正解です。
発生した二酸化炭素は空気より重いので、(二酸化炭素の分子量は 44 で空気の平均分子量は約 28.8 )下方置換法で捕集します。
したがって、気体はエの方法で捕集します。
二酸化炭素を石灰水に通じると白濁します。
Ca(OH)2 + CO2 → CaCO3 + H2O
石灰水には水酸化カルシウム Ca(OH)2 が溶けており、CO2 と反応して炭酸カルシウム CaCO3 が生成します。炭酸カルシウムは水に溶けにくいので沈殿し、白濁します。
これらをまとめると正解は⑦です。
問7 正解 1
1 〇 正しい記述です。
抽出という操作は、茶葉やコーヒー豆から味や香りの成分をお湯に溶かし出す例などがあります。
溶媒に対する溶けやすさの差を利用する例では、混合物に水と油をそれぞれ接触させたとき、混合物中から水に溶けやすい成分は水のなかへ、油に溶けやすい成分は油のなかへと別々に溶けだす現象があります。
この抽出操作によって、混合物中にあった水に溶けやすい成分と油に溶けやすい成分は分離できます。
2 × 沸点の差を利用して、液体中の混合物から成分を分離する方法は分留(または蒸留)です。
原油を加熱して、原油に含まれる軽油・灯油・ナフサ(粗製ガソリン)・石油ガスを分離する操作が分留の例です。
3 × 固体と液体の混合物から、ろ紙などで固体を分離する方法はろ過です。
砂の混ざった水をろ過すると、固体の砂と液体の水に分離できます。
ろ過のほかの例では、水溶液中で沈殿や結晶が生成したときにろ過をすると、水溶液から固体の沈殿や結晶を分離することができます。
4 × 不純物を含む固体を溶媒に溶かし、温度によって溶解度が異なることを利用してより純粋な物質を析出させる操作は、再結晶といいます。
再結晶の例では、塩化ナトリウムと硝酸カリウムの混合物である固体を熱水に溶かす例があります。
水溶液の温度を下げていくと、硝酸カリウムを溶解できる量が減ってくるので、硝酸カリウムの結晶が析出してきます。
この結晶は、水溶液をろ過することで分離できます。
5 × 固体の混合物を加熱して、固体から直接気体になる成分を冷却して分離する操作は、昇華法といいます。
昇華法の例では、砂とヨウ素の混合物を加熱して、ヨウ素の気体を発生させる例があります。
ヨウ素の気体を冷却すれば、ヨウ素だけの固体を分離できます。
第2問
問1 正解 3
ダイヤモンドは炭素原子が共有結合してできています。
炭素の原子量は 12 なので、炭素原子のモル質量は 12 g/mol となります。
問題では 0.1 カラットのダイヤモンド、つまり 0.20 g の炭素の共有結合結晶には、炭素原子が何モルあるかを計算します。
求める炭素の物質量は
\(\frac{0.20[g]}{12[g/mol]}\) ≒ 0.017[mol]
です。
問2 正解 2
1.1 g 生成した CO2 の分子量は 44 です。このなかの炭素原子の質量は、
1.1[g] × \(\frac{12}{44}\) = 0.30[g]
0.90 g 生成した H2O の分子量は 18 です。このなかの水素原子の質量は、
0.90[g] × \(\frac{2.0}{18}\) = 0.10[g]
この有機化合物が完全燃焼した化学反応式は
有機化合物 + O2 → CO2 + H2O
となります。(係数の数値は無視しています。)
ある有機化合物は 0.80 g はじめにあったので、このなかにある酸素原子の質量は、
0.80 - ( 0.30 + 0.10 ) = 0.40[g]
なお、有機化合物に含まれていた元素があとは酸素だけとは書かれていませんが、完全燃焼後に残った化合物からわかります。
CO2 と H2O しか生成していないので、有機化合物には C と H と O だけが含まれていました。
これら 3 つの原子について、存在する質量を原子量で割ると有機化合物の組成式がわかります。
\(\frac{0.30}{12}\) : \(\frac{0.10}{1.0}\) : \(\frac{0.40}{16}\) = 0.025:0.10:0.025 = 1:4:1
つまり、CH4O の整数倍がこの有機化合物の分子式です。
この原子の比率に合うのは、CH3OH しかありません。
問3 正解 3
密度が 1.0 g/cm3 で、質量パーセント濃度 5.0 % の 1 L の溶液には、溶質は
1.0[g/cm3] × 1000[cm3] × \(\displaystyle\frac{5.0}{100}\) = 50[g]
含まれます。
50 g のグルコースの物質量は
\(\displaystyle\frac{50[g]}{180[g/mol]}\) ≒ 0.28[mol]
です。
これより、求める溶液のモル濃度は 0.28[mol/L]
問4 正解 2
滴下量 10 mL の前後で pH が大きく動いているので、この付近が中和点と考えられます。
pH = 5.2 前後で中和しているので、弱塩基に強酸を加えていると思われます。
変色域の pH が 4.2 ~ 6.2 の指示薬ならば、中和点直前の pH = 6.2 まで色は変わらず、中和点を過ぎた直後の pH = 4.2 で色が変わるので、この滴定では適切です。
他の指示薬では、③と④では中和される前に変色してしまいます。①は中和点を少し過ぎたあとでないと変色しません。
このように②以外の指示薬は不適当です。
問5 正解 a 7 b 1
ア CH3COONa 弱酸 (酢酸 CH3COOH) と強塩基 (水酸化ナトリウム NaOH) の塩で、水に溶かすと塩基性です。
イ KCl 強酸 (塩酸 HCl) と強塩基 (水酸化カリウム KOH) の塩で、水に溶かすと中性です。
ウ Na2CO3 弱酸 (炭酸 H2CO3) と強塩基 (水酸化ナトリウム NaOH) の塩で、水に溶かすと塩基性です。
エ NH4Cl 強酸 (塩酸 HCl) と弱塩基 (アンモニア NH3) の塩で、水に溶かすと酸性です。
オ CaCl2 強酸 (塩酸 HCl) と強塩基 (水酸化カルシウム Ca(OH)2) の塩で、水に溶かすと中性です。
カ (NH4)2SO4 強酸 (硫酸 H2SO4) と弱塩基 (アンモニア NH3) の塩で、水に溶かすと酸性です。
問6 正解 4
1 〇 過マンガン酸カリウム水溶液が酸化剤として、シュウ酸が還元剤として酸化還元反応が起こります。この反応で、赤紫色の MnO4- がほぼ無色の Mn2+ となります。
過マンガン酸カリウムが酸化剤としてはたらきます。
半反応式は
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O ‥‥(A)
Mn の酸化数が +7 から +2 へ変化しています。過マンガン酸イオン MnO4- は赤紫色で、マンガン(Ⅱ)イオン Mn2+ はほぼ無色なので、酸化還元反応が進んだことがわかります。
シュウ酸は還元剤としてはたらきます。半反応式は
H2C2O4 → 2 CO2 + 2 H+ + 2 e- ‥‥(B)
C の酸化数が +3 から +4 へ変化しています。
反応式を完成させるには (A)式 × 2 と (B)式 × 5 を両辺足し合わせます。
2 MnO4- + 5 H2C2O4 + 6 H+ → 10 CO2 + 2 Mn2+ + 8 H2O
カリウムイオン( K+ を2個) と硫酸イオン( SO42- を3個) を両辺に加えて、電荷を中性にして完成です。
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 → 10 CO2 + 2 MnSO4 + 8 H2O + K2SO4
2 〇 Na が還元剤としてはたらきます。反応式は次のようになります。
2 Na + 2 H2O → 2 NaOH + H2
Na の酸化数は 0 → +1 に変化しています。
3 〇 銅が酸化されて酸化銅(Ⅱ)になっています。
2 Cu + O2 → 2 CuO
銅の酸化数は 0 → +2 です。
4 × 硝酸銀水溶液 AgNO3 の Ag+ イオンと、食塩水 NaCl の Cl- イオンが反応します。
塩化銀の沈殿では、酸化数の変化はありません。
Ag+ + Cl- → AgCl
5 〇 過酸化水素が酸化剤として、ヨウ化カリウムが還元剤としてはたらきます。
半反応式は
2 I- → I2 + 2 e-
H2O2 + 2 H+ + 2 e- → 2 H2O
半反応式の両辺を足し合わせると
H2O2 + 2 I- + 2 H+ → I2 + 2 H2O
カリウムイオン( K+ を2個)と、硫酸イオン( SO42- )を両辺に加えて、電気的に中性にすれば反応式は完成です。
H2O2 + 2 KI + H2SO4 → I2 + 2 H2O + K2SO4
生成物のヨウ素 I2 と水溶液中のヨウ化物イオン I- から、褐色の三ヨウ化物イオン I3- が生じます。
問7 正解 6
イオン化傾向の大きな金属の方が、陽イオンとなりやすいです。陽イオンとなるとき、電子が失われており、酸化されています。
このように、イオン化傾向の大きな金属は酸化されて陽イオンとなり、水溶液中に溶け出します。
酸化反応で放出された電子は、導線を通ってイオン化傾向の小さな金属の方へ流れていき、水溶液中の電解質と還元反応を起こします。
電池では、酸化反応が起こり電子が流れ出る側が負極で、電子を受けて還元反応が起こる側が正極です。
