第1問
問1 正解 a 1 b 4
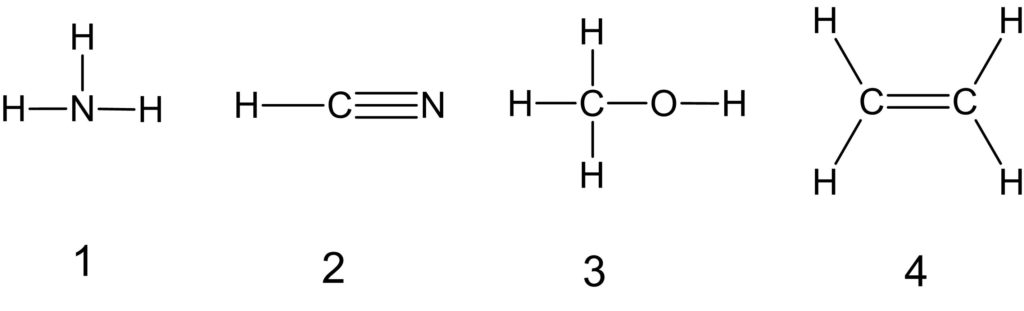
アは電子の数が 2 なので、原子番号 2 の He の電子配置と同じです。
同様にイは原子番号 6 の C の電子配置、ウは原子番号 10 の Ne の電子配置、エは原子番号 11 の Na の電子配置、オは原子番号 17 の Cl の電子配置と同じです。
a
1 価の陽イオンとして( 1 個の電子を放出して)アの電子配置となるのは、原子番号 3 の Li です。
また 1 価の陰イオンとして( 1 個の電子を受け取って)ウの電子配置となるのは、原子番号 9 の F です。
これらが化合物となるので、①が正解です。
b
1 〇 He は K 殻が電子 2 個で満たされて閉殻となっており、化学的に反応性の乏しい希ガス(貴ガス)です。そのため他の原子とは結合しにくいです。
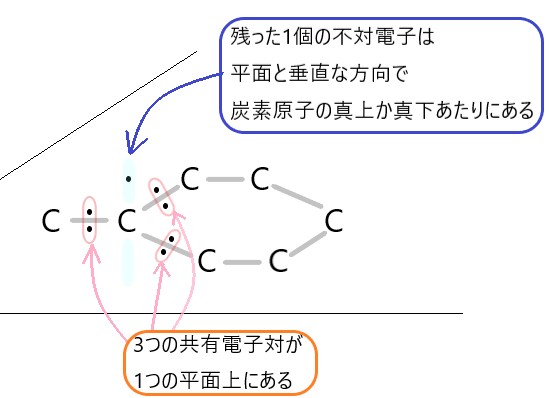
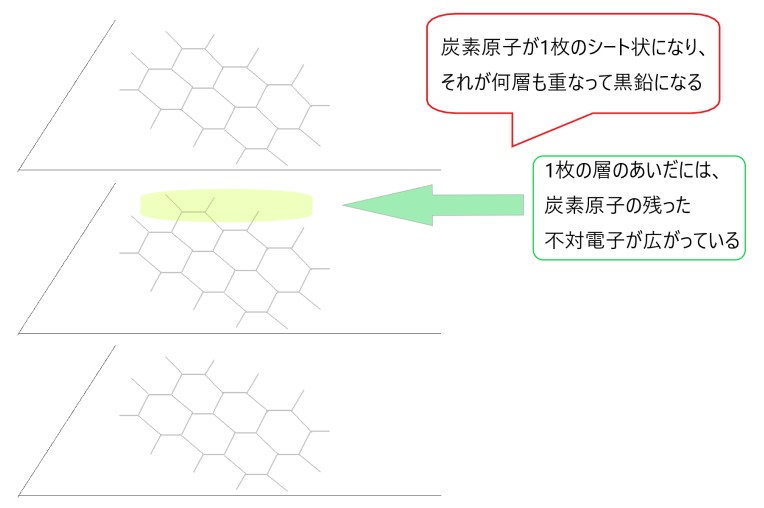
2 〇 C は 4 つの不対電子をもち、単結合、二重結合、三重結合をつくることができます。
3 〇 He 、Ne 、Ar などの希ガス(貴ガス)は、常温・常圧で気体です。
4 × 電子を放出して陽イオンとなるのに必要なエネルギーが、イオン化エネルギーです。周期表の左下の元素(最外殻の電子数が少ない元素)は、イオン化エネルギーが小さくなる傾向です。
5 〇 Cl は不対電子を 1 個もつので、H と共有結合をつくり HCl 分子となります。
問2 正解 1
1 〇 ①の記述は蒸留(分留)の説明です。石油は蒸留(分留)によって成分を分離します。石油は加熱すると、沸点の異なる成分が順番に気体となって分離できます。
2 × ②の記述は昇華法の説明です。
3 × ③の記述は抽出の説明です。
4 × ④の記述は再結晶の説明です。
問3 正解 6
ア 塩化ナトリウム NaCl は、Na+ と Cl- がクーロン力でイオン結合したイオン結晶です。
イ ケイ素 Si は、共有結合の結晶をつくります。
ウ カリウム K は金属なので、金属結晶です。
エ ヨウ素 I2 は、分子が分子間力によって配列されてできた分子結晶です。ただし I2 は分子なので、ヨウ素 I 原子同士は共有結合でつながっています。
オ 酢酸ナトリウム CH3COONa は、CH3COO- と Na+ からできたイオン結晶です。ただし酢酸イオン CH3COO- は、共有結合でイオンが構成されています。
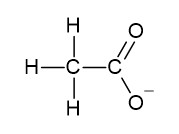
以上より、イ・エ・オが当てはまります。
問4 正解 5
1 〇 100 K のグラフの曲線を見ると、横軸 240 m/s にピークの山があります。したがって、速さが 240 m/s である分子の数の割合が最も高いといえます。
2 〇 横軸が 240 m/s の位置で垂直に上にグラフを見ていくと、はじめに 500 K の曲線があり、次に 300 K 、最後に 100 K の曲線があります。
したがって、分子の数の割合が最も少ないのが 500 K で、次に少ないのが 300 K 、分子の数の割合が最も多いのが 100 K とわかります。
3 〇 横軸が 800 m/s の位置で垂直に上にグラフを見ていくと、はじめに 100 K の曲線があり、次に 300 K 、最後に 500 K の曲線があります。
したがって、分子の数の割合が最も少ないのが 100 K で、次に少ないのが 300 K 、分子の数の割合が最も多いのが 500 K とわかります。
4 〇 3 つの曲線を見ると、100 K 、300 K 、500 K と温度が上がるにつれて、分子の数の割合の曲線はピークの高さが低くなり、横への広がりが大きくなります。
低い温度ではゆっくりとした速さの分子が多いですが、温度が上がると分子の速さの値が大きい分子が増え、分子の速さの分布は右側へ広がっていきます。
5 × 500 K では、540 m/s の速さをもつ分子の数の割合が最も多いです。( 500 K では分子の速さの分布のピークが 540 m/s です。)
1000 K になると、分子はさらに速く動くようになるので、分布は 500 K より右側にずれて広がります。
分布のピークが 540 m/s より右に移動し、分布のグラフの山も平らに広がるので、540 m/s の速さをもつ分子の数の割合は減少すると考えられます。
問5 正解 1
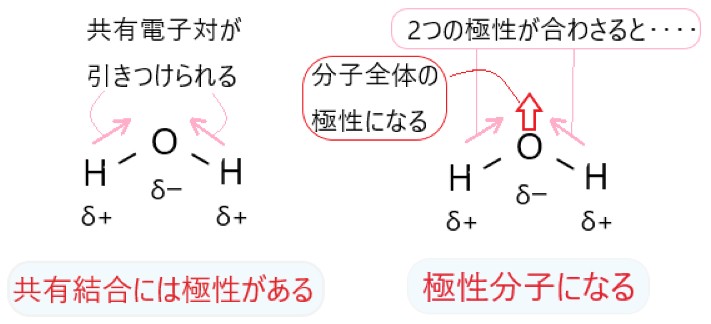
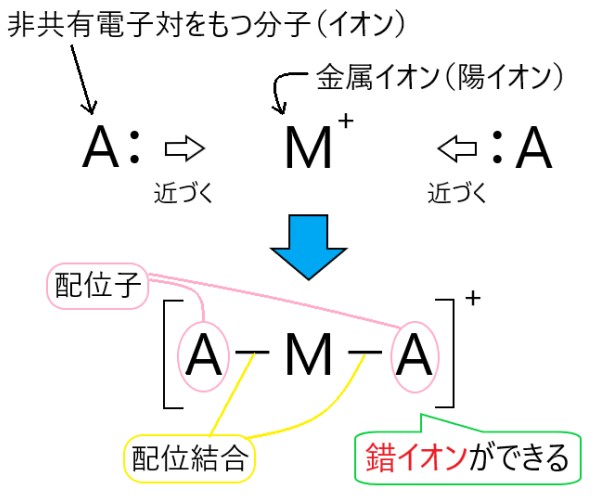
1 〇 アンモニア NH3 の窒素原子は 1 つの非共有電子対をもつので、これを電子を失っている H+ に提供して、アンモニウムイオン NH4+ となります。
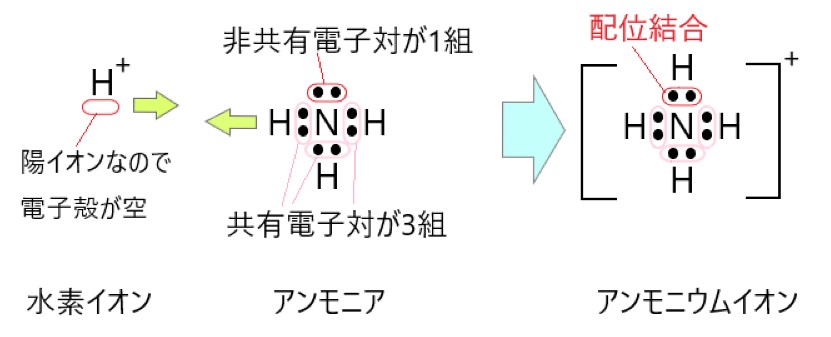
2 〇 配位結合は、一度それができてしまうと、他の共有結合と同等になります。
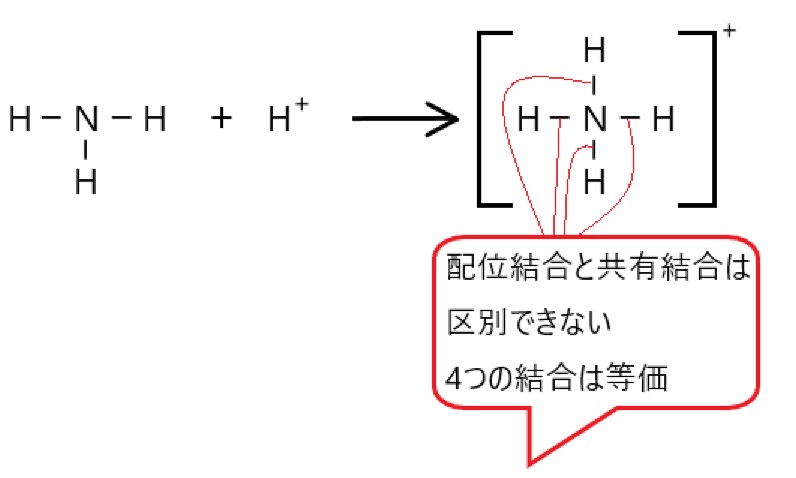
3 〇 配位結合は、非共有電子対をもつ原子が 、2 つの電子を他の原子やイオンに提供することでできます。
以下は非共有電子対をもつ原子を含む分子が、金属イオンと配位結合する模式図です。
問6 正解 2
濃度不明の希硫酸 H2SO4 10.0 mL と、0.10 mol/L の塩酸 HCl 20.0 mL から得られる H+ の物質量を式で表します。
これが 0.50 mol/L の 水酸化ナトリウム NaOH 水溶液 20.0 mL から得られる OH- の物質量と等しくなります。
H2SO4 は 2 価の酸、HCl は 1 価の酸、NaOH は 1 価の塩基なので、濃度不明の希硫酸の濃度を C mol/L とすると、
$$C mol/L × 2 × \frac{10.0 mL}{1000 mL} + 0.10 mol/L × 1 × \frac{20.0 mL}{1000 mL}$$
$$= 0.50 mol/L × 1 × \frac{20.0 mL}{1000 mL}$$
これを解くと、C = 0.40 mol/L
問7 正解 6
Fe2O3 では、酸素原子 O の酸化数は -2 、化合物全体の酸化数の和は 0 なので、
鉄原子 Fe の酸化数は Fe × 2 + (-2) × 3 = 0 より +3 となります。
鉄 Fe の単体では Fe の酸化数は 0 、酸素 O2 の単体でも O の酸化数は 0 です。
したがって Fe の酸化数は 0 → +3 、O の酸化数は 0 → -2 と変化します。
問8 正解 ア 4 イ 3
鉛 Pb は、二次電池である鉛蓄電池の電極として用いられます。また Pb の板は放射線を通さないので、放射線が発生する現場(病院の放射線診療室など)で遮蔽板として使われます。
銀 Ag は、金属の中で最もよく熱や電気を伝えます。二番目に熱伝導性や電気伝導性が高い金属は銅 Cu です。
問9 正解 4
除去された SiO2 の質量は 2.00 g - 0.80 g = 1.20 g です。
Si の原子量は 28 、O の原子量は 16 なので、SiO2 の式量は 28 + 16 × 2 = 60 です。
1.20 g の SiO2 の中に含まれるケイ素原子 Si の質量は
1.20[g] × \(\frac{28}{60}\) = 0.56[g]
したがって求めるケイ素 Si の含有率は
\(\frac{0.56[g]}{2.00[g]}\) × 100 = 28 %
です。
第2問
問1 正解 a ア 2 イ 3 ウ 5 b 1
a
カリウム K の原子番号は 19 で、カリウム原子のもつ陽子の数と電子の数は 19 です。電子配置は K 殻に 2 個、L 殻に 8 個、M 殻に 8 個、N 殻に 1 個となります。
カリウムイオン K+ は 1 個の電子が失われるので、原子核の陽子は 19 個、電子は K 殻に 2 、L 殻に 8 、M 殻に 8 の配置となります。
同様にカルシウム Ca の原子番号は 20 で、カルシウム原子のもつ陽子の数と電子の数は 20 です。電子配置は K 殻に 2 個、L 殻に 8 個、M 殻に 8 個、N 殻に 2 個となります。
カルシウムイオン Ca2+ は 2 個の電子が失われるので、原子核の陽子は 20 個、電子は K 殻に 2 、L 殻に 8 、M 殻に 8 の配置となります。
以上のように、Ca2+ では原子核中に存在する粒子である陽子の数が K+ より多く、原子核の正電荷が大きいです。
そのため Ca2+ の方が、静電気的な引力で強く電子殻の電子を引きつけるので、イオン半径は小さくなります。
b
KNO3 の溶解度曲線を見ると、 40 ℃で 64 g となっています。つまり 40 ℃では KNO3 は水 100 g に 64 g まで溶けます。
今 40 ℃の KNO3 の飽和水溶液 164 g があるので、これは水 100 g に KNO3 を 64 g 溶かしたということです。
一方、25 ℃では KNO3 の溶解度は 38 g です。これは水 100 g に KNO3 が最大 38 g 溶けることを示します。
40 ℃で水 100 g に溶解している 64 g の KNO3 は、25 ℃で 38 g までしか溶解しないので
64 - 38 = 26 g の KNO3 が析出します。
KNO3 の式量は 101 なので、析出する KNO3 の物質量は
\(\frac{26[g]}{101[g/mol]}\) ≒ 0.26 mol
問2 正解 a 3 b 4 c 2
a
まず BaCl2 水溶液の滴下量の値を横軸、電流の大きさを縦軸として方眼紙にプロットして(点をつけて)みましょう。
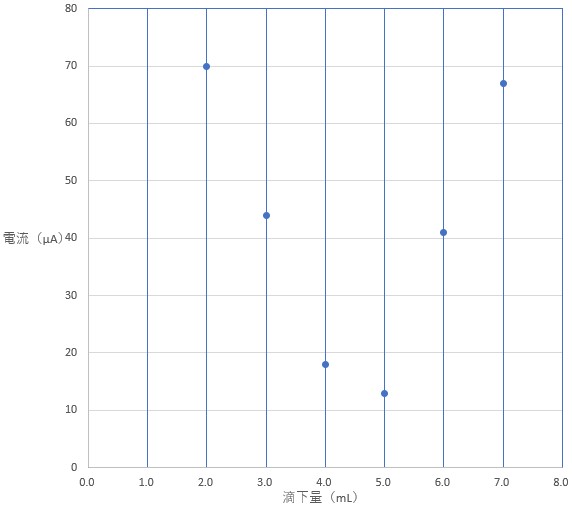
6 つの測定点をどのように見たらよいでしょうか。
2.0 、3.0 、4.0 mL と滴下量が増えると電流の値が小さくなり、さらに 5.0 、6.0 、7.0 mL と滴下量が増えると電流の値が大きくなるように見えます。
これは問題文の説明から考えて、2.0 ~ 4.0 mL では BaCl2 を滴下すると沈殿を生じる反応が進み、水溶液中の Ag+ イオンと SO42- イオンが減少したために電流が流れにくくなったと推測できます。
反応が進み沈殿が生成するあいだは、滴下した BaCl2 はすべて沈殿するので、Ba2+ イオンや Cl- イオンは水溶液中で増えません。
滴下量が 5.0 ~ 7.0 mL のときは、BaCl2 の滴下により水溶液中の Ag+ イオンと SO42- イオンは沈殿反応で消費され、既に存在しません。
5.0 ~ 7.0 mL では、BaCl2 の滴下によって増えた Ba2+ 、Cl- イオンが電気を通します。
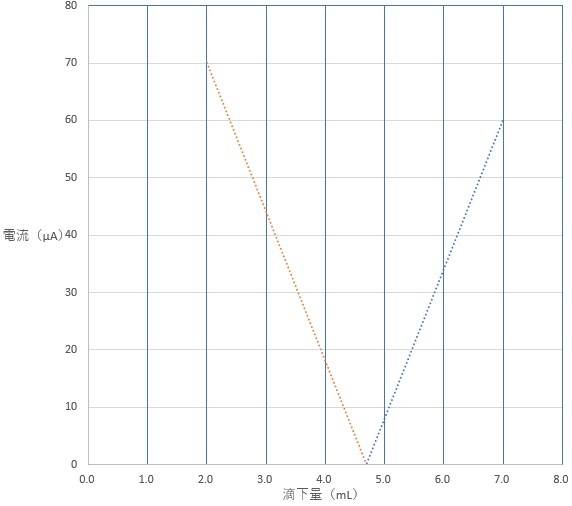
完全に沈殿反応が終了したときを調べるため、滴下量 2.0 、3.0 、4.0 mL の点を通るような直線を近似として、 滴下量 5.0 、6.0 、7.0 mL の点を通るような直線を近似として、2 直線を方眼紙にひきます。
理想では、この 2 直線は電流の値が 0(縦軸の値が 0 )の点で交わります。
この電流の値 0 の点が、水溶液中にイオンが存在しないときであり、すなわち Ag2SO4 が完全に反応したときです。(以下は理想的なグラフです。)
実際に方眼紙に書き込むと次のようなグラフになります。(実験のデータなので、理想的な形状にはなりません。)
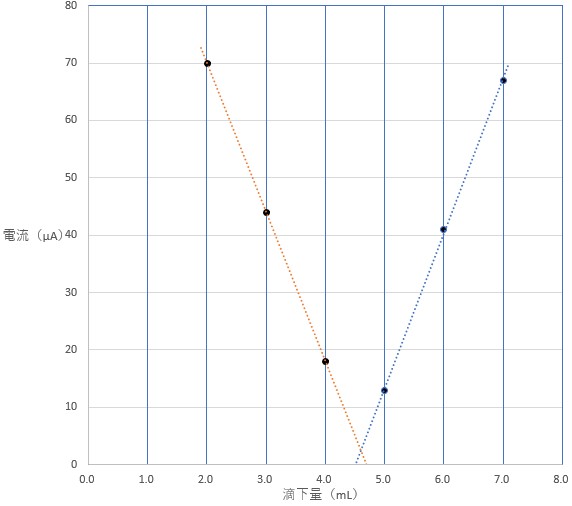
グラフより、滴下量 4.6 mL が正解です。
b
Ag2SO4 + BaCl2 → BaSO4 ↓ + 2 AgCl ↓
と反応するので、Ag2SO4 1 mol から AgCl の沈殿は 2 mol 生成します。
0.010 mol/L のAg2SO4 水溶液 100 mL が完全に沈殿したとき、Ag2SO4 の物質量は
0.010[mol/L] × \(\frac{100[mL]}{1000[mL]}\)[L] = 0.0010[mol]
ありました。
AgCl の式量は 143.5 なので、生成する沈殿 AgCl の質量は
0.0010[mol] × 2 × 143.5[g/mol] ≒ 0.29[g]
c
Ag2SO4 と BaCl2 は 1:1 の物質量の比で反応します。
BaCl2 水溶液を 4.6 mL 滴下すると完全に反応するので、b で計算した Ag2SO4 の物質量 0.0010 mol の値を使います。
BaCl2 水溶液のモル濃度を C mol/L とすると、
0.0010[mol] = C[mol/L] × \(\frac{4.6 mL}{1000 mL}\)[L]
これを解くと
C = \(\frac{1}{4.6}\) ≒ 0.22[mol/L]