もくじ
第1問
問1 正解 4
原子の電子配置は、一般に内側の電子殻から順番に電子が入っていきます。
またイオンの電子配置は、もとの原子に最も近い希ガスの電子配置と同じになります。
1 〇 炭素原子は原子番号 6 で、電子の数は 6 個です。K 殻に 2 個、L 殻に 4 個の電子があります。
2 〇 硫黄原子は原子番号 16 で、電子の数は 16 個です。電子は K 殻に 2 個、L 殻に 8 個、M 殻に 6 個入ります。最外殻の電子数が 6 個なので、価電子は 6 個です。
3 〇 ナトリウム原子の原子番号は 11 で、電子は 11 個あります。1 価の陽イオンであるナトリウムイオン Na+ は電子を 1 個失っており、電子を 10 個持ちます。
フッ素原子は原子番号 9 で、電子を 9 個持ちます。1 価の陰イオンであるフッ化物イオン F- は電子を 1 個受け取っており、電子を 10 個持ちます。
このように、ナトリウムイオンとフッ化物イオンの電子数はどちらも 10 個で、同じ電子配置になります。
なお電子を 10 個もつ原子は、それぞれの原子と近い大きさである希ガスのネオン Ne です。
4 × 窒素とリンはどちらも 15 族の元素です。最外殻の電子数はどちらも 5 個です。
窒素原子は原子番号 7 で、電子を 7 個持ちます。電子配置は K 殻に 2 個、L 殻に 5 個です。
リン原子は原子番号 15 で、電子を 15 個持ちます。電子配置は K 殻に 2 個、L 殻に 8 個、M 殻に 5 個です。
問2 正解 3
オの部分は典型元素です。
3 族から 11 族の範囲が遷移元素です。それ以外の 1 ~ 2 族、12 ~ 18 族は典型元素です。( 12 族を遷移元素に含めるものもあります。)
1 〇 1 族と 2 族は典型元素です。
2 〇 3 ~ 11 族は遷移元素です。
3 × 12 ~ 15 族はすべて典型元素です。
4 〇 13 ~ 16 族はすべて典型元素です。
5 〇 17 族は典型元素で、ハロゲンと呼ばれます。18 族は典型元素で、希ガスと呼ばれます。
問3 正解 2 5
これらの分子内には原子同士の共有結合である O-H 結合、C=O 結合、N-H 結合、C-O 結合、C-H 結合があります。この 5 つの共有結合にはすべて極性があります。
そこで、分子全体として極性が打ち消されるものを選びます。
1 × H2O は折れ線形の分子のため、O-H 結合の極性が打ち消されないので、分子全体で極性があります。
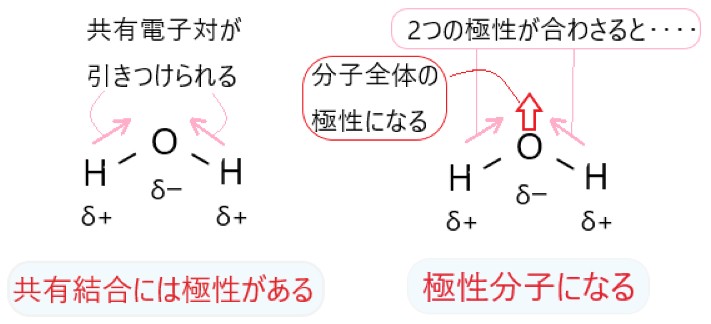
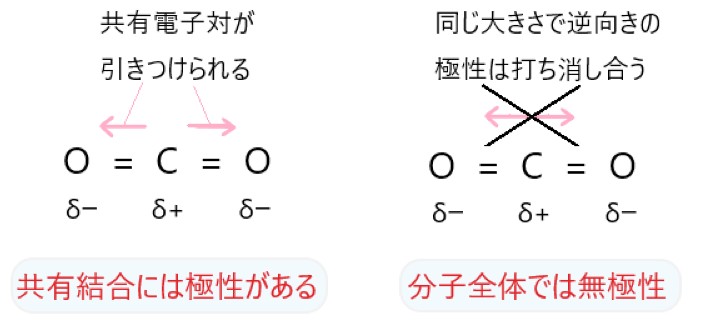
2 〇 CO2 は直線形の分子のため、C=O 結合の極性が逆向きとなって打ち消され、分子全体では極性はありません。
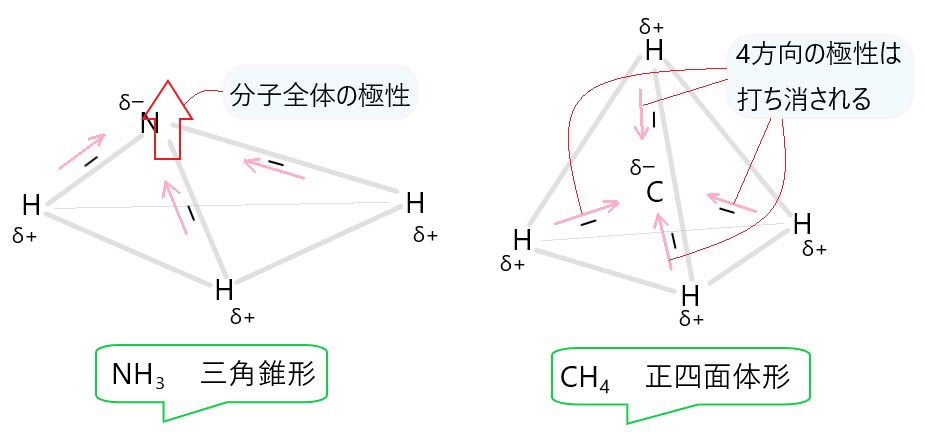
3 × NH3 は三角錐形なので、N-H 結合の極性が打ち消されません。そのため、分子全体で極性があります。
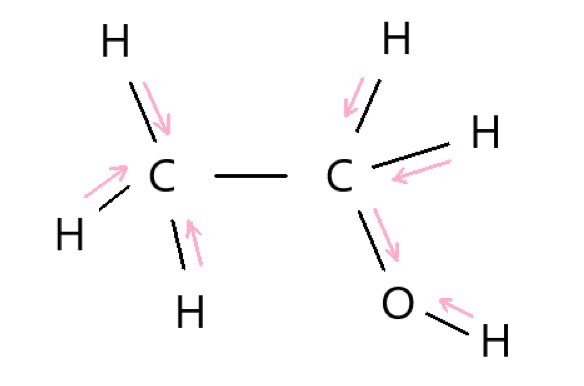
4 × C2H5OH は立体的に折れ曲がった構造です。C-H 結合、C-O 結合、O-H 結合それぞれに極性があり、これらの極性は打ち消されないので、分子全体でも極性があります。
5 〇 CH4 は正四面体形の分子であり、C-H 結合の極性がすべて正四面体の中心に向いています。そのため分子全体では、極性が打ち消されて極性はありません。
選択肢 3 の図を参照してください。
問4 正解 2
1 〇 沸点以下の温度でも、液体は液面から蒸発してゆっくりと気体になっています。
2 × ヨウ素 I2 や二酸化炭素(ドライアイス) CO2 は、気体から固体に、また固体から気体に状態変化します。気体から固体、固体から気体への状態変化は昇華と言います。
3 〇 一定温度でも、気体分子の速度にはばらつきがあります。空間を速く飛びまわる分子も、ゆっくり動く分子もあります。
温度が高くなると気体分子の動きは活発になるので、気体分子の平均の速度は速くなります。
4 〇 分子は、気体・液体・固体のどの状態でも熱運動をしています。固体の分子結晶では分子の位置が決まっているので、分子はその位置で振動しています。
問5 正解 5
蒸留操作で沸点を測定するときは、温度計の下端部を枝付きフラスコの分岐する高さに合わせます。
これは冷却器の方向へ流れる気体の温度を正確に測るためです。
蒸留操作では、三角フラスコで集めた液体が何であるか確かめたいです。そのために、この液体の沸点を測定しておきます。
純物質は沸点が正確に決まっているので、それと比較して集めた液体が目的とする物質なのかを確認することができます。
この実験では蒸留水を集めることを目的としているので、加熱して沸騰したときに温度計が 100 ℃を示していれば、蒸留水が得られていると推測できます。
以上より、手順Ⅰに関する注意点の選択肢は ウ です。
次に、アダプターと三角フラスコの接続部をどうするかという設問です。
アダプターと三角フラスコをゴム栓でつないで密閉すると、加熱により実験装置内の圧力が高まって危険です。
実験装置を密閉して加熱すると、ガラス器具が割れたり、接続部分のゴム栓が吹き飛んだりする恐れがあります。
そこでこの実験では、異物が三角フラスコに入らないようにアルミ箔で覆うだけにとどめます。
したがって、手順Ⅱに関する注意点の選択肢は エ です。
問6 正解 4
得られた CaSO4・2 H2O の物質量は、\(\frac{8.6[g]}{172[g/mol]}\) = 0.050[mol]です。
この沈殿は、水溶液中の Ca2+ イオンと SO42- イオンから生成します。そのため十分な量の硫酸ナトリウムがある場合、Ca2+ イオン 1 mol から CaSO4・2 H2O の沈殿が 1 mol 得られます。
また、CaBr2 は水溶液中で以下のように電離します。
CaBr2 → Ca2+ + 2 Br-
そのため、CaBr2 を 1 mol 溶かすと、2 mol の臭化物イオン Br- が水溶液中に存在します。
したがって、水溶液中の臭化物イオン Br- が 0.024 mol 存在したということは、CaBr2を 0.012 mol 溶解させたとわかります。
CaBr2 を 0.012 mol 溶かすと、CaSO4・2 H2O は 0.012 mol 沈殿します。
したがって沈殿物のうち 0.050[mol] – 0.012[mol] = 0.038[mol] が、CaCl2 から生成したものです。
問7 正解 1
1 × ボーキサイトの主成分は Al2O3・nH2O です。製錬されるアルミニウムの原料となるのがボーキサイトです。
ガラス、シリカゲル、石英、ケイ砂、水晶などの原料となるのが二酸化ケイ素です。
2 〇 塩素を水に溶かすと次亜塩素酸 HClO が生成します。次亜塩素酸には殺菌、漂白作用があります。
Cl2 + H2O → HCl + HClO
3 〇 エチレン C2H4 が連続的に反応してできた高分子がポリエチレンです。
4 〇 白金はイオン化傾向がとても小さいので、反応性に乏しい金属です。このように、白金や金は安定した金属元素です。
第2問
問1 正解 5
原子の質量数の総和 M が 70 となる塩素分子は、質量数 35 の塩素原子と質量数 35 の塩素原子が共有結合してできたものです。
同様に、原子の質量数の総和 M が 72 となる塩素分子は、質量数 35 の塩素原子と質量数 37 の塩素原子が共有結合してできたものです。
同様に、原子の質量数の総和 M が 74 となる塩素分子は、質量数 37 の塩素原子と質量数 37 の塩素原子が共有結合してできたものです。
質量数 35 の塩素原子は 76 %の比率で存在しているので、質量数の総和 M が 70 の塩素分子となる割合は 76% × 76% ≒ 58% です。

問2 正解 1
モル濃度が 0.25 mol/L で 200 mL ( = 0.200 L ) の NaNO3 水溶液には、NaNO3 が
0.25[mol/L] × 0.200[L] = 0.050[mol]
含まれます。
これから調製したい(つくりたい)、モル濃度が 0.12 mol/L で 500 mL ( = 0.500 L ) の NaNO3 水溶液について考えます。
この調製したい NaNO3 水溶液には、NaNO3 が
0.12[mol/L] × 0.500[L] = 0.060[mol]
含まれているはずです。
そのため、加えなければならない NaNO3 の物質量は
0.060[mol] - 0.050[mol] = 0.010[mol]
です。
また、NaNO3 の式量(モル質量 [g/mol] )は、23 + 14 + 16 × 3 = 85 です。
したがって、加える NaNO3 の質量は
85[g/mol] × 0.010[mol] = 0.85[g]
となります。
問3 正解 A 8 B 4
問題の選択肢から水溶液 A と B について、1 価の強酸である塩酸、1 価の弱酸である酢酸、1 価の強塩基である水酸化ナトリウムの可能性を考えます。
滴定曲線のグラフを見ると、pH 12(強塩基の領域)から、水溶液 B を 15 mL 滴下したところで pH 7 よりは塩基性側で中和して、pH 4~5(弱酸の領域)に至っています。
滴定開始前に pH = 12 ということは、水素イオン濃度 [H+] は 1.0 × 10-12 mol/L です。
水のイオン積
Kw = [H+] [OH-] = 1.0 × 10-14 mol2/L2
より、
[OH-] = 1.0 × 10-2 mol/L になります。最初に pH = 12 なので、水溶液 A として、0.01 mol/L の強塩基がビーカーに入っていたとわかります。これに当てはまるのは、0.010 mol/L の水酸化ナトリウムです。
この塩基 150 mL を水溶液 B 15 mL で中和しています。
水溶液 B は塩酸か酢酸のどちらかですが、いずれも 1 価の酸なので、酸の濃度は塩基の 10 倍だとわかります。
したがって、酸の濃度は 0.10 mol/L です。
さらに、中和点が弱塩基性であること、中和反応後に酸を加え続けると溶液が弱酸性になることから、この酸は弱酸と考えられます。
したがって、水溶液 B は 0.10 mol/L 酢酸水溶液とわかります。
問4 正解 3
ア~ウは、酸と塩基の中和反応でできた塩です。
中和反応で生成する塩を水に溶かすと、その液性は塩によって決まります。
ア 塩化ナトリウム NaCl は、強酸の塩化水素(塩酸) HCl と強塩基の水酸化ナトリウム NaOH からできた塩です。
この塩を水に溶かすと中性であり、pH 7 となります。
イ 炭酸水素ナトリウム NaHCO3 は、弱酸の炭酸 H2CO3 と強塩基の水酸化ナトリウム NaOH からできた塩です。
NaHCO3 の水溶液では、炭酸水素イオン HCO3- とナトリウムイオン Na+ が存在します。
このうち Na+ はイオンのまま存在しますが、炭酸水素イオン HCO3- は一部が H+ を受け取り塩基として働きます。
HCO3- + H2O → H2CO3 + OH-
NaHCO3 水溶液では水酸化物イオン OH- が生じるので、この水溶液は弱塩基性を示します。
したがって pH は 7 より大きくなります。
ウ 硫酸水素ナトリウム NaHSO4 は、強酸の硫酸 H2SO4 と強塩基の水酸化ナトリウム NaOH からできた塩です。
NaHSO4 の水溶液には、硫酸水素イオン HSO4- とナトリウムイオン Na+ が存在します。
このうち Na+ はイオンのまま存在しますが、硫酸水素イオン HSO4- の一部はさらに H+ を放出して酸として働きます。
HSO4- → H+ + SO42-
NaHSO4 水溶液では水素イオン H+ が生じるので、この水溶液は弱酸性を示します。
したがって pH は 7 より小さくなります。
まとめると pH が大きい順に
NaHCO3 水溶液 > NaCl 水溶液 > NaHSO4 水溶液
問5 正解 2
1 〇 酸化還元反応で発生する化学エネルギーを電気エネルギーに変えるのが電池です。
2 × 電池の放電時には、負極で酸化反応が起こり電子が放出され、この電子が正極に移動して還元反応が起こります。
このとき電流は、正極から負極へと流れます。
3 〇 正しい記述です。
4 〇 水素を燃料とする燃料電池の反応では、水素と酸素から水が生成します。
負極の活物質に水素 H2 、正極の活物質に酸素 O2 が用いられます。
負極では H2 が電子を放出して H+ となります。この H+ が正極で酸素 O2 と還元反応をして、水 H2O が生成します。
負極の反応は H2 → 2 H+ + 2 e- です。
正極の反応は O2 + 4 H+ + 4 e- → 2 H2O です。
電池全体の反応は 2 H2 + O2 → 2 H2O です。
問6 正解 1
イオン化傾向の大きさと、溶液の性質(酸化力)を見て判断します。
1 〇 硝酸銀 AgNO3 水溶液には、銀イオン Ag+ と硝酸イオン NO3- が存在します。
鉄 Fe は銀 Ag よりもイオン化傾向が大きいので、鉄が溶けて陽イオンとなり、陽イオンだった銀が析出します。
2 Ag+ + Fe → 2 Ag + Fe2+
2 × 硫酸銅(Ⅱ) CuSO4 水溶液には、銅イオン Cu2+ と硫酸イオン SO42- が存在します。
水溶液中には水素イオン H+ も存在しますが、H と Cu では Cu の方がイオン化傾向が小さいので、H+ は陽イオンのままで水溶液中に残ります。
そのため、H+ が電子を受け取って、水素が発生することはありません。
亜鉛が溶けて、水素よりイオン化傾向の小さい銅イオン Cu2+ が電子を受け取り析出します。
Zn + Cu2+ → Zn2+ + Cu
3 × 希硝酸は酸化力が強いので銅を溶かします。
希硝酸と銅の半反応式は以下の通りです。
HNO3 + 3 H+ + 3 e- → NO + 2 H2O
Cu → Cu2+ + 2 e-
この 2 つの半反応式から電子を消去して整理すると、
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
反応式からわかるように、水素は発生せず、一酸化窒素が発生します。
4 × アルミニウムは濃硝酸に溶けますが、溶け始めると表面が酸化被膜で覆われます(不動態)。
酸化被膜は濃硝酸に溶けないので、アルミニウム板が溶け続けることはありません。
