もくじ
第1問
問1 正解 6
空気は窒素 N2 や酸素 O2 、アルゴン Ar 、二酸化炭素 CO2 など多くの純物質が混ざっているので、混合物です。その存在比は窒素 N2 が約 78 %、酸素 O2 が約 21 %、アルゴンが約 0.93 %、二酸化炭素が約 0.04 % ‥‥となっています。
メタンは CH4 という化学式で表される純物質です。CH4 は C と H の二つの元素からできている物質なので、化合物です。
オゾンは O3 という化学式で表される純物質です。 O3 は酸素元素 O のみからできており、一つの元素でつくられている物質なので単体です。
以上より、正解は⑥です。
問2 正解 2
1 0 ℃、1.013 × 105 Pa の状態で体積が 22.4 L の気体の物質量は 1 mol です。
したがってこの酸素 O2 の物質量は 1 mol です。
気体の酸素 O2 では、1 個の O2 分子のなかに酸素原子は 2 個あります。
そのため、1 mol の O2 には 2 mol の酸素原子が含まれます。
2 水 H2O の分子量は、 1.0 × 2 + 16 = 18 です。
分子量が 18 なので、モル質量は 18 g/mol となります。
したがって 18 g の水 H2O の物質量は\(\frac{18[g]}{18[g/mol]}\) = 1.0 mol
水 H2O の 1 分子のなかに含まれる酸素原子は 1 個なので、水 18 g に含まれる酸素原子の物質量は 1.0 mol です。
3 過酸化水素 H2O2 の分子が 1 個あるとき、それに含まれる酸素原子は 2 個です。
したがって H2O2 が 1.0 mol あれば、それに含まれる酸素原子の物質量は 2.0 mol です。
4 黒鉛 C を完全燃焼させたときの化学反応式は
C + O2 → CO2
したがって黒鉛 C が 1 mol 反応すれば、CO2 は 1 mol 生成します。
ここで C の原子量は 12 なので、
黒鉛 12 g の物質量は\(\frac{12[g]}{12[g/mol]}\) = 1.0 mol
よって CO2 は 1.0 mol 生成しています。
1 個の CO2 分子には 2 個の酸素原子が含まれるので、1.0 mol の CO2 に含まれる酸素原子の物質量は 2.0 mol です。
以上より、①、③、④の酸素原子の物質量は 2 mol であり、②の酸素原子の物質量は 1 mol です。
問3 正解 a 3 b 40 10
原子番号が増えていくと、つまり陽子の数(電子の数)がひとつずつ増えていくと、それぞれの原子はどうなるのかという問題です。
a
原子番号は陽子の数と一致しますので、これに当てはまるのはイのグラフです。
価電子の数は、原子の最外殻の電子数と一致します。ただし希ガス(貴ガス)の元素は価電子の数が 0 です。
具体的に考えると、原子番号 1 の H では、最外殻電子数が 1 なので価電子の数は 1 です。原子番号 2 の He は、希ガス(貴ガス)の元素なので価電子の数は 0 です。原子番号 3 の Li は、最外殻電子数が 1 なので価電子の数は 1 です。
これを続けていくと、ウが価電子の数のグラフであるとわかります。
残りのアが、中性子の数のグラフとなります。
中性子の数はだいたいその原子の陽子の数と同じ程度ですが、原子によって少しばらつきます。
b
質量数 = 陽子の数 + 中性子の数
となるので、アのグラフの値とイのグラフの値の和が最大となる原子を求めます。
これをグラフから読み取ると、原子番号 18 の Ar が陽子の数 18 、中性子の数 22 となり、和(質量数)が最大です。
したがって最大の質量数は 18 + 22 = 40 となります。
次に M 殻に電子がなく、原子番号が最大の原子を考えます。
原子の電子配置では、はじめに 2 個の電子が K 殻に入り、次に 8 個の電子が L 殻に入ります。その次に電子は M 殻に入っていきます。
そのため、M 殻に電子が入るまでに K 殻と L 殻で 10 個の電子が入ります。10 個の電子が入る原子が、原子番号が最も大きくなるので、求めるこの原子の原子番号は 10 です。
問4 正解 5
金属結晶は自由に結晶内を動ける自由電子をもつので、電気を通します。
分子結晶は分子が規則正しく並んだ固体なので、動ける電子やイオンがなく、電気を通しません。
また、多くの共有結合の結晶も自由に動ける電子やイオンをもたないので、電気を通しません。
ただし例外として、共有結合の結晶である黒鉛は電気を通します。これは黒鉛の構造によるものです。
黒鉛は炭素原子がまわりの 3 つの炭素原子と 120° の角度で共有結合し、正六角形の構造をつくっています。

このとき、炭素原子は 4 つの不対電子のうち 3 つを共有結合に使っていますが、残りの 1 つの電子は黒鉛の平面構造の層のあいだにあります。
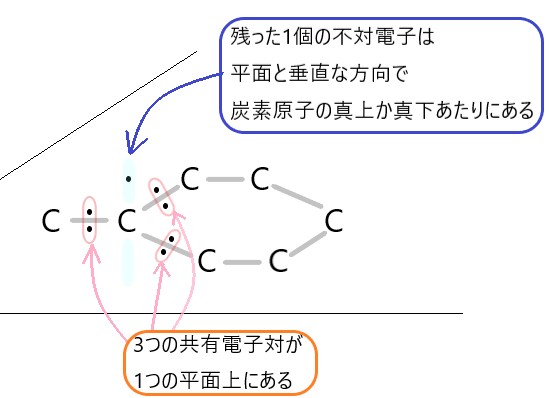
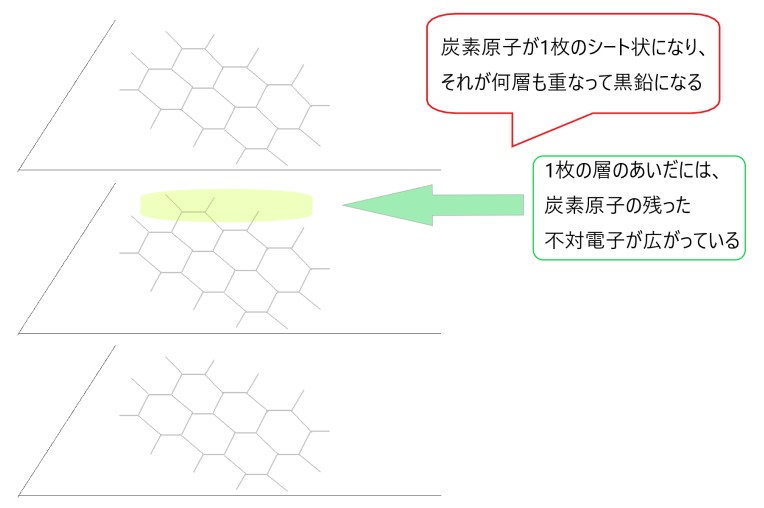
正六角形の繰り返し構造により炭素原子が平面に並び、これが何層も重なって黒鉛ができています。この層のあいだにある電子が動くので、黒鉛は電気を通します。
問5 正解 4
イオン化傾向の大きな金属は反応性が高く、イオン化傾向の小さな金属は化学的に安定です。
Li 、K 、Ca 、Na は常温の水と反応します。
Mg は熱水と反応します。
Al 、Zn 、Fe は高温の水蒸気と反応します。
Ni よりイオン化傾向の小さい金属は、水と反応しません。

問6 正解 4
1 × CO は Fe2O3 から酸素を受け取り CO2 となるので、酸化されています。自身が酸化されているので、CO は還元剤です。
CO のうちの炭素原子 C の酸化数は +2 → +4 と変化しています。(酸素原子 O は -2 のまま)
2 × NH4Cl は弱塩基 NH3 と強酸 HCl から生成した弱塩基の塩です。これが強塩基 NaOH と反応し、弱塩基の NH3 が遊離しています。
これは酸塩基の反応であり、酸化数に変化はありません。
3 × Na2CO3 は弱酸 H2CO3 と強塩基 NaOH から生成した弱酸の塩です。これが強酸 HCl と反応し、弱酸の塩の NaHCO3 と強酸の塩の NaCl が生成しています。
さらに HCl を加えた場合は
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
となり、弱酸の H2CO3 が遊離します。
(H2CO3 はすぐに分解して、H2O と CO2 になります。)
この反応は酸塩基の反応なので、酸化数に変化はありません。
4 〇 これは Br2 が酸化剤、KI が還元剤である酸化還元反応です。
Br2 のうちの臭素原子 Br の酸化数は 0 → -1 と変化し、還元されています。
KI のうちのヨウ素原子 I の酸化数は -1 → 0 と変化し、酸化されています。
(カリウム原子 K の酸化数は +1 のまま)
問7 正解 1
100 mL の溶液の質量は、密度との積として求められます。(100 mL = 100 cm3 )
100[cm3] × d[g/cm3] = 100d[g]
この溶液に含まれる溶質の質量は、質量パーセント濃度が x %なので、
$$100d[g] \times \frac{x}{100} = xd[g]$$
となります。
溶質のモル質量が M[g/mol] なので、質量が xd[g] である溶質の物質量は
$$\frac{xd}{M}[mol]$$
問8 正解 5
問題文で示されたイオン反応式から、
正極では 4 mol の電子が流れると 2 mol の水が生成し、負極では 2 mol の電子が流れると 1 mol の水素が消費されるとわかります。
すなわち正極では 2 mol の電子が流れると 1 mol の水が生成します。
まとめると、2.0 mol の電子 e- が流れると 1.0 mol の水 H2O が生成し、1.0 mol の水素 H2 が消費されます。
1.0 mol の水 H2O の質量は、H2O の分子量が 18 なので 18 g です。
1.0 mol の水素 H2 の質量は、H2 の分子量が 2.0 なので 2.0 g です。
以上より、⑤が正解です。
第2問
問1 正解 a 3 b 3
a
正塩とは、酸と塩基が完全に中和して、酸の H+ や塩基の OH- が生成した塩に残っていないものをいいます。
1 酸の H2SO4 と塩基の Cu(OH)2 が完全に中和して CuSO4 という塩になっているので、正塩です。
2 酸の H2SO4 と塩基の NaOH が完全に中和して Na2SO4 という塩になっているので、正塩です。
3 H2SO4 は 2 価の酸なので、1 つの分子から 2 つの H+ が生じます。また NaOH は 1 価の塩基です。
H2SO4 が 1 mol と NaOH が 2 mol の比で反応するとき、完全に中和します。
NaHSO4 は酸 H2SO4 と塩基 NaOH が中和した塩ですが、中和反応がまだ途中です。
H2SO4 + NaOH → NaHSO4 + H2O
という反応では、H2SO4 の H+ がまだ塩に残っています。
NaHSO4 + NaOH → Na2SO4 + H2O
まで反応が進むと、中和反応が完了します。
したがって H+ が残っているので、NaHSO4 は酸性塩です。
4 NH4Cl は H+ が残っているようにも見えますが、これは正塩です。
酸 HCl と塩基 NH3 が中和してできた塩が NH4Cl です。
HCl は 1 価の塩、NH3 は 1 価の塩基であり、
HCl + NH3 → NH4Cl
の反応で、中和は完了しています。
b
陽イオン交換樹脂から出てくる水素イオンの物質量は、問題文より
水素イオンの物質量 = 陽イオンの価数 × 陽イオンの物質量
となります。
ここではア~エは同じモル濃度・同じ体積なので、モル濃度を c mol/L 、体積を v L とおいて、ア~エで陽イオンの価数と陽イオンの物質量の積を比較します。
ア KCl → K+ + Cl-
上のように水溶液中で電離するので、1 価 × c [mol/L] × v [L] = cv [mol]
cv mol の K+ と交換されるので、cv mol の H+ が得られます。
イ NaOH → Na+ + OH-
上のように水溶液中で電離するので、1 価 × c [mol/L] × v [L] = cv [mol]
cv mol の Na+ と交換されるので、cv mol の H+ が得られます。
ただしこの場合は、水溶液中に同量の OH- が存在するので中和反応が起こり、
H+ + OH- → H2O
となるので、H+ の物質量はかなり少なくなります。
ウ MgCl2 → Mg2+ + 2 Cl-
上のように水溶液中で電離するので、2 価 × c [mol/L] × v [L] = 2cv [mol]
2cv mol の H+ が得られます。
エ CH3COONa → CH3COO- + Na+
上のように水溶液中で電離するので、1 価 × c [mol/L] × v [L] = cv [mol]
cv mol の Na+ と交換されるので、cv mol の H+ が得られます。
ただしこの場合は、水溶液中に同量の CH3COO- が存在します。
酢酸 CH3COOH は弱酸で一部の分子だけが電離しているので、
CH3COO- + H+ → CH3COOH
のような反応が起こり、H+ が酢酸の生成のために消費されるので、H+ の物質量は cv mol より少なくなります。
以上より、正解はウの③です。
問2 正解 a 2 b 2 c 1
a
CaCl2 は強酸 HCl と強塩基 Ca(OH)2 の塩であり、この塩の水溶液は中性です。
1 濃度が 0.100 mol/L の 2 価の強酸 H2SO4 10.0 mL と、濃度が 0.100 mol/L の 1 価の強塩基 KOH を混合すると、
酸から H+ は 2 × 0.100 × \(\frac{10[mL]}{1000[mL]}\) mol 生じます。
塩基から OH- は 1 × 0.100 × \(\frac{10[mL]}{1000[mL]}\) mol 生じます。
酸が余るので、混合した水溶液は酸性です。
2 濃度が 0.100 mol/L の 1 価の強酸 HCl 10.0 mL と、濃度が 0.100 mol/L の 1 価の強塩基 KOH を混合すると、完全に中和します。
強酸と強塩基から生成した塩 KCl の水溶液となるので、水溶液は中性になります。
3 濃度が 0.100 mol/L の 1 価の強酸 HCl 10.0 mL と、濃度が 0.100 mol/L の 1 価の弱塩基 NH3 を混合すると、完全に中和します。
強酸と弱塩基から生成した塩 NH4Cl の水溶液となるので、水溶液は酸性になります。
4 濃度が 0.100 mol/L の 1 価の強酸 HCl 10.0 mL と、濃度が 0.100 mol/L の 2 価の強塩基 Ba(OH)2 を混合すると、
酸から H+ は 1 × 0.100 × \(\frac{10[mL]}{1000[mL]}\) mol 生じます。
塩基から OH- は 2 × 0.100 × \(\frac{10[mL]}{1000[mL]}\) mol 生じます。
塩基が余るので、混合した水溶液は塩基性です。
b
「この実験は何の目的で行われるのか」を理解しましょう。
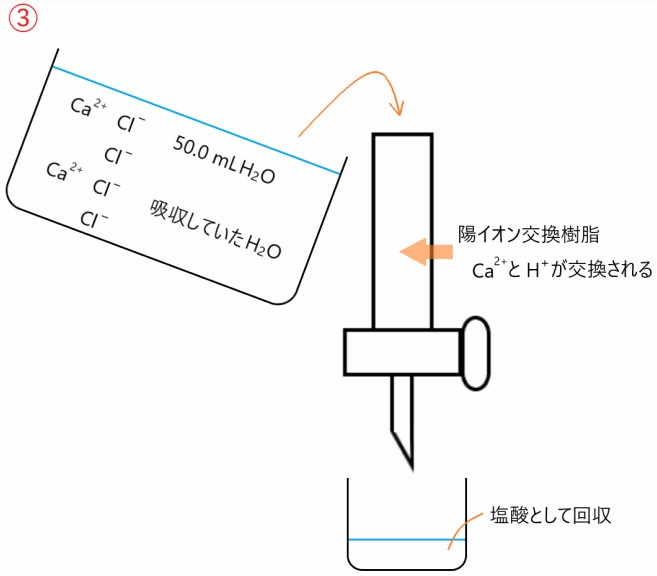
CaCl2 は H2O を吸収するので、実験室に放置された CaCl2 がどれだけ H2O を吸収しているのかを調べるのが、実験の目的です。
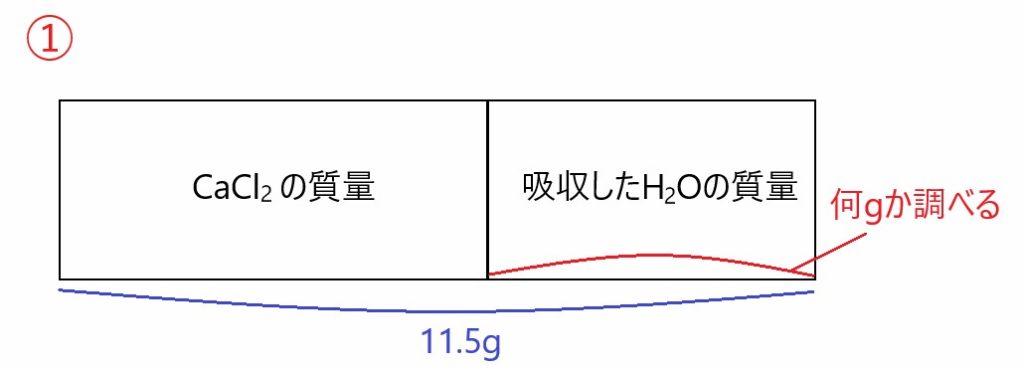
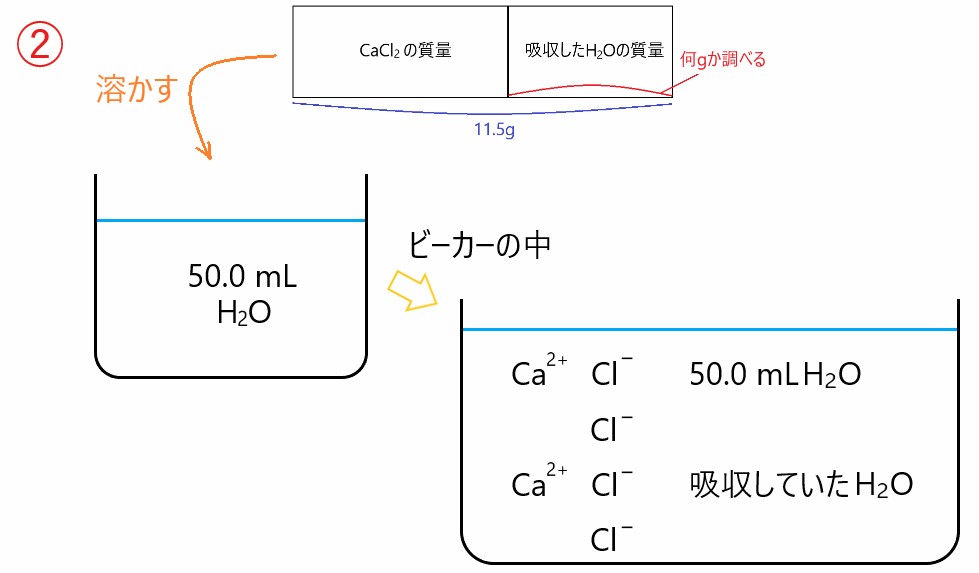
11.5 g の( H2O を吸収している)CaCl2 を 50.0 mL の水に溶かすと
CaCl2 → Ca2+ + 2 Cl-
のように電離するので、溶かした水溶液には Ca2+ 、Cl- 、50.0 mL の H2O 、吸収していた H2O が含まれます。
このうち Ca2+ を陽イオン交換樹脂により H+ と交換します。交換した H+ を塩酸としてすべて回収し、その一部を中和滴定します。
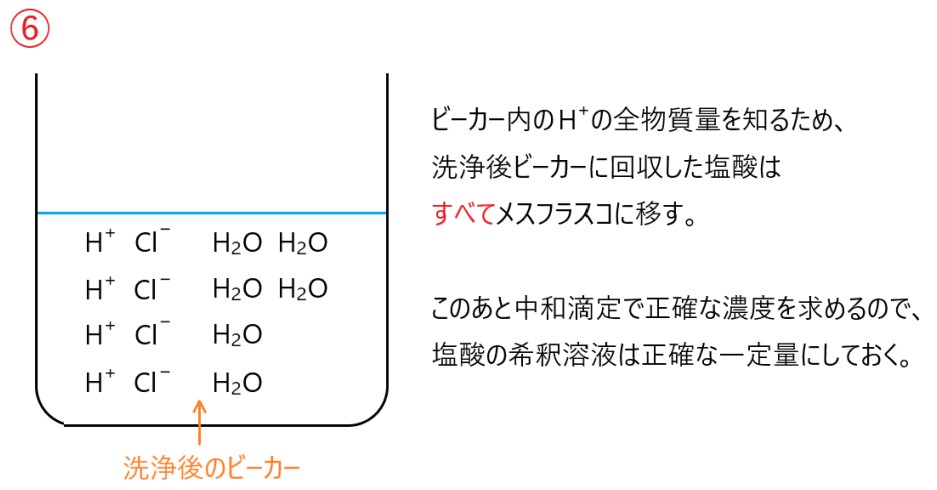
回収した塩酸を正確な一定量の溶液とし、その一部を中和滴定で正確な濃度を知ることで、H+ の全体量を計算できます。
そのため、得られたすべての塩酸をメスフラスコに移し、水を加えて一定量の溶液とします。したがって正解は②です。
*****
(***で挟まれた文は、本問の解説を読み終わったあともう一度読み返してください。)
実験全体でみるとわかりますが、11.5 g の塩化カルシウムを 50.0 mL の水に溶かしていますが、50.0 mL という体積に意味はありません。別に 60 mL でも 100 mL でもかまいません。
もっと言えば、体積をはかる必要すらありません。約 50 mL の水に溶かしたなどで OK です。
重要なのは、溶かして陽イオン交換樹脂を詰めたガラス管に通し、さらに純水で洗い流した後に回収した溶液(ここでは塩酸)の体積を正確にメスフラスコではかる(ここでは 500 mL )ことです。
純水でガラス管の中の陽イオン交換樹脂を洗い流すという操作があるので、溶かした水の体積はどうでもよいのです。
それより、Ca2+ をすべて H+ に交換して、ガラス管から回収した溶液(塩酸)の体積を正確にメスフラスコで一定量( 500 mL )に調製する、という操作が大切です。
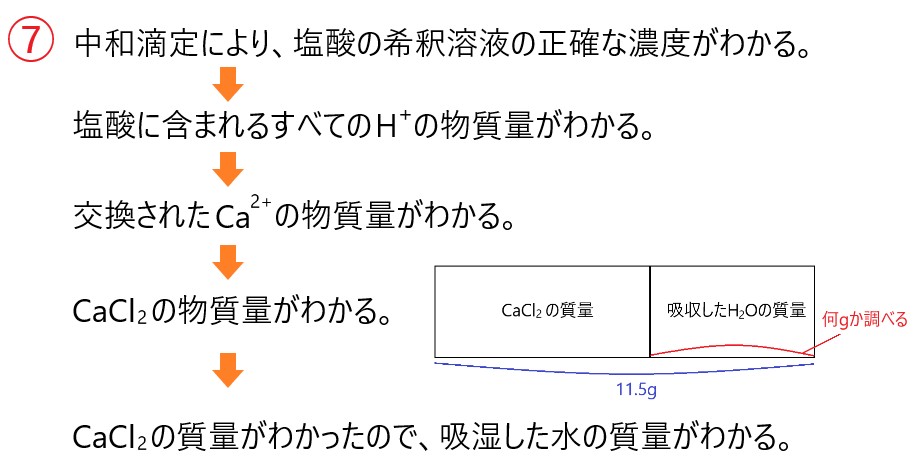
回収した塩酸を正確な一定量の希釈溶液とし、さらにそこからホールピペットで正確にはかりとった希釈溶液を中和滴定することで、希釈溶液の濃度がわかり、塩酸全量の物質量がわかります。
塩酸全量の物質量がわかるので H+ の全物質量がわかり、交換した Ca2+ の物質量がわかるのです。
交換した Ca2+ の物質量がわかれば水に溶かす前の CaCl2 の物質量がわかり、CaCl2 の質量がわかります。
CaCl2 の質量がわかれば、最後に 11.5 g との差から吸収した H2O の質量がわかります。

*****
c
Ca2+ イオン 1 個が陽イオン交換樹脂にくっつくと、代わりに H+ イオンが 2 個放出されます。
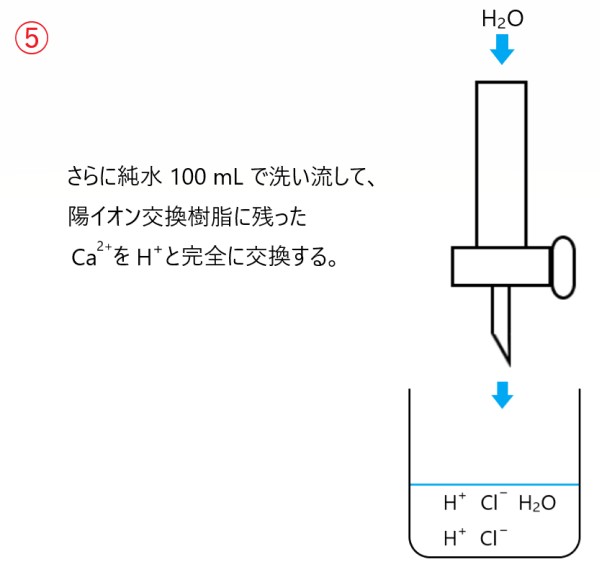
さらに純水約 100 mL で洗い流します。これはガラス管内の陽イオン交換樹脂に残った Ca2+ と H+ を完全に交換するための操作です。
この洗い流す操作では、単に回収したビーカーの溶液(塩酸)に H2O が増えるだけと考えてよいです。
ガラス管内を純水で洗い流したので、はじめのビーカーの水溶液中にあった Ca2+ は完全に H+ に置き換わりました。
また H+ イオンの物質量は Ca2+ の物質量の 2 倍になります。
500 mL にした希釈溶液からホールピペットで 10.0 mL とり、0.100 mol/L の NaOH 水溶液で中和滴定しました。この希釈溶液の濃度を C mol/L とすると、HCl は 1 価の酸、NaOH は 1 価の塩基なので、
$$1 × C[mol/L] × \frac{10.0}{1000}[L] = 1 × 0.100[mol/L] × \frac{40.0}{1000}[L]$$
これを解くと C = 0.400 mol/L
希釈溶液の HCl の濃度が 0.400 mol/L とわかったので、この 500 mL に含まれる H+ の物質量は
0.400[mol/L] × \(\frac{500[mL]}{1000[mL]}\) = 0.200[mol]
となります。
Ca2+ 1 mol 当たり H+ 2 mol と交換されているので、交換前の Ca2+ の物質量は 0.100 mol です。
CaCl2 → Ca2+ + 2 Cl-
と電離するので、Ca2+ が 0.100 mol あれば CaCl2 が 0.100 mol あったことになります。
CaCl2 の式量は 111 なので、はじめの塩化カルシウムに CaCl2 は
0.100[mol/L] × 111[g/mol] = 11.1[g]
含まれていました。
求める吸湿した水の質量は、
11.5[g] - 11.1[g] = 0.4[g]
となり、正解は①の 0.4 g です。
