もくじ
第1問
問1 正解 5
1 × 海水には水 H2O 、塩化ナトリウム NaCl 、塩化マグネシウム MgCl2 など複数の純物質が含まれています。多くの純物質が混ざっているので、海水は混合物です。
2 × 食酢は純物質である水 H2O 、酢酸 CH3COOH などが含まれた混合物です。
3 × 塩酸は純物質である水 H2O 、塩化水素 HCl が含まれた混合物です。
4 × コンクリートはカルシウム Ca 、ケイ素 Si 、アルミニウム Al など、さまざまな物質が含まれた混合物です。
5 〇 グルコースは、グルコースというただひとつの物質から成ります。
グルコースは、分子式が C6H12O6 である純物質です。純物質 1 種類からなる物質なので、これは純物質です。
6 × 青銅は銅 Cu 、スズ Sn などが含まれる合金です。複数の純物質が含まれるので、これは混合物です。
7 × 銑鉄は鉄 Fe 、炭素 C などが含まれた混合物です。
問2 正解 8
酸素原子 O は 16 族の典型元素で、価電子は 6 、最外殻の電子数は 6 です。
①~⑧のなかで 16 族の元素があれば、酸素原子と最外殻の電子数は同じです。
なお酸素原子は原子番号が 8 であり、陽子数と電子数は 8 個です。K 殻に 2 個、L 殻に 6 個の電子が入っています。
1 × Al は 13 族の元素です。Al は原子番号が 13 で、K 殻に 2 個、L 殻に 8 個、M 殻に 3 個の電子が入っています。(最外殻電子数は 3 個)
2 × C は 14 族の元素です。C は原子番号が 6 で、K 殻に 2 個、L 殻に 4 個の電子が入っています。(最外殻電子数は 4 個)
3 × Cl は 17 族の元素です。Cl は原子番号が 17 で、K 殻に 2 個、L 殻に 8 個、M 殻に 7 個の電子が入っています。(最外殻電子数は 7 個)
4 × Li は 1 族の元素です。Li は原子番号が 3 で、K 殻に 2 個、L 殻に 1 個の電子が入っています。(最外殻電子数は 1 個)
5 × Mg は 2 族の元素です。Mg は原子番号が 12 で、K 殻に 2 個、L 殻に 8 個、M 殻に 2 個の電子が入っています。(最外殻電子数は 2 個)
6 × Ne は 18 族の元素です。Ne は原子番号が 10 で、K 殻に 2 個、L 殻に 8 個の電子が入っています。(最外殻電子は 8 個)
7 × P は 15 族の元素です。P は原子番号が 15 で、K 殻に 2 個、L 殻に 8 個、M 殻に 5 個の電子が入っています。(最外殻電子数は 5 個)
8 〇 S は 16 族の元素です。S は原子番号が 16 で、K 殻に 2 個、L 殻に 8 個、M 殻に 6 個の電子が入っています。(最外殻電子数は 6 個)
問3 正解 6
1 〇 粒子が規則正しく並んでできている固体を、結晶といいます。分子結晶は、分子が規則正しく並んでいる固体です。
2 〇 分子同士を結びつける力はイオン結合より弱いので、小さなエネルギー(低い温度)で分子結晶はバラバラになります。
そのため、一般に分子結晶の融点はイオン結晶より低くなります。
3 〇 分子結晶であるドライアイス( CO2 )やヨウ素( I2 )は固体から気体へ、または気体から固体へと昇華します。
4 〇 分子結晶は、分子同士を引き合わせる分子間力でできています。
5 〇 分子結晶には移動できる電子やイオンがないので、一般に電気を通しにくいです。
6 × 水が固体となった氷は、分子結晶です。
H2O 分子には極性があり、この極性ではたらく引力によって分子同士がつながり、分子結晶をつくっています。(この分子間の引力を特に水素結合と呼びます。)
問4 正解 a 4 b 2
ア CO2 は C = O 結合に極性がありますが、分子が直線形で極性は打ち消されます。
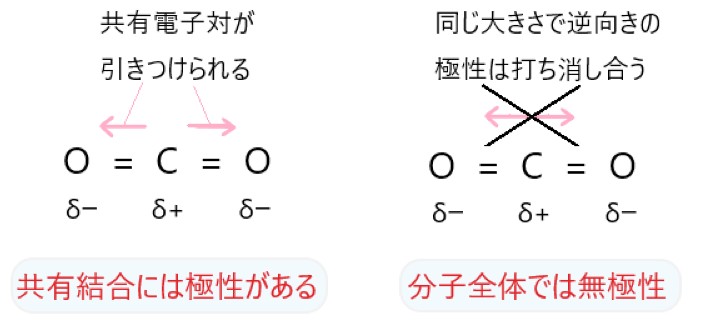
イ Cl2 では、Cl-Cl 結合に極性はありません。
同じ原子どうしの共有結合なので、電気陰性度に差はありません。そのため、共有電子対はそれぞれの塩素原子の中央にあります。
電荷の偏りがないので、この共有結合に極性はありません。二原子分子なので、分子全体でも極性はありません。
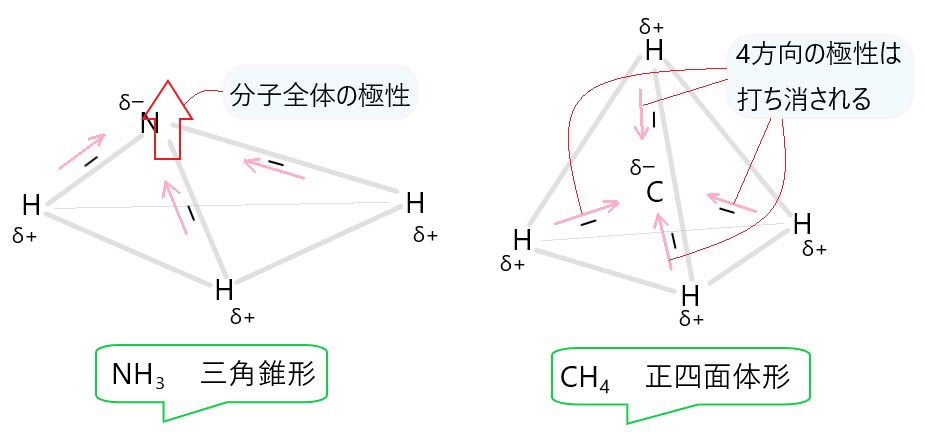
ウ NH3 は N-H 結合に極性があります。分子は三角錐形で極性があります。
エ H2 は H-H 結合に極性はありません。
同じ原子どうしの共有結合なので、電気陰性度に差はありません。そのため、共有電子対はそれぞれの水素原子の中央にあります。
電荷の偏りがないので、この共有結合に極性はありません。二原子分子なので、分子全体でも極性はありません。
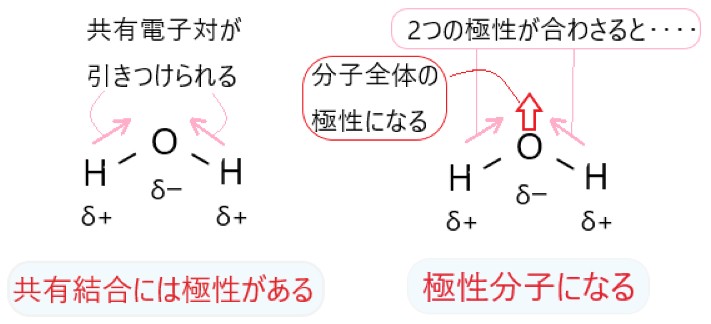
オ H2O は O-H 結合に極性があります。分子は折れ線形で極性があります。
カ CH4 は C-H 結合に極性がありますが、分子が正四面体形で極性は打ち消されます。
選択肢ウの図を参照してください。
問5 正解 3
カリウムの原子量は、2 つの同位体の相対質量と存在比から求められる平均の質量のことです。
そこで質量数 41 のカリウム 41K の存在比を X パーセント、質量数 39 のカリウム 39K の存在比を (100 - X) パーセントとします。
$$39.10 = 40.96 × \frac{X}{100} + 38.96 × \frac{(100 - X)}{100}$$
これを解くと X = 7.0
問6 正解 6
洗浄した白金線(白金でできた細長い棒)を調べたい溶液に浸し、ガスバーナーの外炎に入れると、元素に特有な色の炎が観察できます。これを炎色反応といいます。
炎色反応の色は元素によって違うので、炎色反応を利用して、溶液中に何の元素が含まれていたかを調べることができます。
1 〇
2 〇
3 〇 外炎のほうが内炎より温度が高いです。
4 〇
5 〇
6 × 遷移元素には、鉄やニッケル、銅、銀、金、白金などの金属の元素が含まれます。
このうち遷移元素である銅 Cu は、炎色反応(青緑色)を示すので、⑥が誤りとなります。
問7 正解 1
1 × ビタミンC(アスコルビン酸)は酸化防止剤として食品に含まれます。
2 〇 ステンレス鋼は鉄 Fe 、クロム Cr 、ニッケル Ni の合金で、さびにくい素材です。
3 〇 プラスチックは小さな分子が繰り返し反応して結合することで、大きな分子となりできています。
4 〇 加熱すると二酸化炭素を発生させ、食品をふくらませることができます。
2 NaHCO3 → Na2CO3 + H2O + CO2
5 〇 塩化カルシウムは水分を吸収するので、乾燥剤として使われます。
6 〇 アンモニア NH3 は植物の栄養素である窒素の原料となります。アンモニアから生成した塩化アンモニウム、硝酸アンモニウム、硫酸アンモニウム、尿素などが肥料となります。
第2問
問1 正解 4
これらの物質はすべて化合物ですので、複数の元素からできています。
このなかで酸素原子の含有率が最も低いものが、1 g 中に含まれる酸素の質量が最も小さいものとなります。
1 二酸化ケイ素 SiO2 の式量は 28 + 16 × 2 = 60
SiO2 1 分子のなかに酸素原子は 2 個あるので、
二酸化ケイ素 SiO2 分子の質量のうち、酸素原子の質量の比率は \(\frac{32}{60}\) ≒ 0.53
したがって、この物質 1 g 中に含まれる酸素の質量は約 0.53 g です。
2 水 H2O の分子量は 1.0 × 2 + 16 = 18
H2O 1 分子のなかに酸素原子は 1 個あるので、
水 H2O 分子の質量のうち、酸素原子の質量の比率は \(\frac{16}{18}\) ≒ 0.89
したがって、この物質 1 g 中に含まれる酸素の質量は約 0.89 g です。
3 二酸化炭素 CO2 の分子量は 12 + 16 × 2 = 44
CO2 1 分子のなかに酸素原子は 2 個あるので、
二酸化炭素 CO2 分子の質量のうち、酸素原子の質量の比率は \(\frac{32}{44}\) ≒ 0.73
したがって、この物質 1 g 中に含まれる酸素の質量は約 0.73 g です。
4 一酸化二窒素 N2O の分子量は 14 × 2 + 16 = 44
N2O 1 分子のなかに酸素原子は 1 個あるので、
一酸化二窒素 N2O 分子の質量のうち、酸素原子の質量の比率は \(\frac{16}{44}\) ≒ 0.36
したがって、この物質 1 g 中に含まれる酸素の質量は約 0.36 g です。
問2 正解 3
M や N の関係がわかりにくいので、アボガドロ定数を使って整理します。
アボガドロ定数を NA とします。
分子量 M の物質 1 g の物質量は、\(\frac{1}{M}\) モルです。
また定義より、分子が 1 モルあるとき、その分子の個数は NA 個になります。
分子量 M の物質 1 g 中の分子の個数が N なので、
\(\frac{1}{M}\) × NA = N
が成立します。この式を変形して NA を表すと
NA = MN ‥‥(1)
また、分子量 18 の物質 100 g の物質量は、\(\frac{100}{18}\) モルです。
分子量 18 の物質 100 g 中にある分子の個数を X とすると
X = \(\frac{100}{18}\) × NA
となります。
上の式に (1) 式を代入すれば
$$X = \frac{100MN}{18}$$
となり、③が正解です。
問3 正解 8
Ca と Li は反応性が高いので、常温の水と激しく反応して水素を発生します。希硫酸とも反応します。
Ca + 2 H2O → Ca(OH)2 + H2
2 Li + 2 H2O → 2 LiOH + H2
Al と Fe は希硫酸と反応して水素を発生します。
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
Fe + H2SO4 → FeSO4 + H2
Ag は常温の水や希硫酸とは反応しません。
問4 正解 1
1 〇 シュウ酸二水和物 (COOH)2・2 H2O のモル質量は、(12 + 16 × 2 + 1.0) × 2 + (1.0 × 2 + 16) = 126[g/mol]
12.6 g のシュウ酸二水和物の物質量は
\(\frac{12.6[g]}{126[g/mol]}\) = 0.100[mol]
これを水に溶かして 1.00 L の水溶液にしているので、シュウ酸のモル濃度は 0.100 mol/L となります。
2 × 1.00 mol/L の塩酸の密度は 1.00 g/cm3 ではないので、塩酸 10.0 g をとってもその体積がわからず、含まれる HCl の物質量が計算できません。
これに水 990 g を加えても塩化水素 HCl の物質量は不明なので、塩酸のモル濃度もわかりません。
3 × 水を加えたあとの硫酸は 10 倍に希釈されているので、モル濃度が\(\frac{1}{10}\)となり 0.0100 mol/L となります。
硫酸は 2 価の強酸なので、水素イオン濃度は 0.02 mol/L に近くなります。
[H+] = 0.02[mol/L] の水溶液は pH 2 より小さいので、この溶液も pH 2 よりは小さいです。4 × 質量パーセント濃度を 10.0 % にするためには、100 g の水酸化ナトリウムを水に溶かして 1000 g の水溶液にしなければなりません。
そのため、900 g の水を加えます。
問5 正解 1
中和点では以下の等式が成り立っています。
酸のモル濃度 × 酸の価数 × 酸の体積 = 塩基のモル濃度 × 塩基の価数 × 塩基の体積
そこで、求める酸のモル濃度を A [mol/L] とすると、
$$A[mol/L] × n × \frac{x[ml]}{1000[ml]} = c[mol/L] × m × \frac{y[ml]}{1000[ml]}$$
式を変形して A を表すと
$$A = \frac{cmy}{nx}[mol/L]$$
となります。
問6 正解 2
1 〇 水酸化バリウム Ba(OH)2 は 2 価の強塩基です。
2 × 塩酸は塩化水素 HCl を水に溶かした溶液で、強酸です。強酸なので水溶液中で電離して、H+ イオンと Cl- イオンが存在します。水溶液中にあるイオンが電気を運ぶため、塩酸は電気を通します。
3 〇 ブレンステッド・ローリーの酸の定義のとおり、相手に水素イオンを与える物質は酸です。
4 〇 水素イオン H+ と水酸化物イオン OH- の濃度が等しいときは、酸と塩基の濃度が等しいことになり中性です。
5 〇 塩化アンモニウムは弱塩基と強酸の塩であり、強塩基である水酸化ナトリウムを加えると、弱塩基のアンモニアが遊離します。
NH4Cl + NaOH → NaCl + NH3 + H2O
問7 正解 4
ヨウ化カリウム KI 中のヨウ化物イオン I- は還元剤としてはたらき、ヨウ素 I2 になります。
過酸化水素 H2O2 は酸化剤としてはたらき、還元されて水 H2O になります。
これらの酸化還元反応の半反応式は
2 I- → I2 + 2 e-
H2O2 + 2 H+ + 2 e- → 2 H2O
となります。
上の 2 式を加えて e- を消去すると
2 I- + H2O2 + 2 H+ → I2 + 2 H2O
水溶液中にはカリウムイオン K+ と硫酸イオン SO42- があるので、これらを使って電気的に中性にできます。
両辺に 2 K+ と SO42- を加えて整理すると、反応式が完成します。
2 KI + H2O2 + H2SO4 → I2 + K2SO4 + 2 H2O
この反応式(イオン反応式の段階でもわかります)から、H2O2 1 mol が反応すると I2 が 1 mol 生成することがわかります。
H2O2 の分子量は 1.0 × 2 + 16 × 2 = 34 です。
例えば、生成した I2 が 0.01 mol ならば、H2O2 の消費量は
34[g/mol] × 0.01[mol] = 0.34[g]
となり、この結果は④のグラフと一致します。
