もくじ
第1問
問1 正解 5
炭素の同素体には、黒鉛、ダイヤモンド、フラーレン、カーボンナノチューブがあります。
黒鉛とカーボンナノチューブは電子を通しやすく、ダイヤモンドとフラーレンは電気を通しにくいです。
黄リンはリンの同素体の一つで、毒性が強く自然発火する性質があります。
硫黄の同素体には、斜方硫黄、単斜硫黄、ゴム状硫黄があります。ゴム状硫黄には、引っ張るとゴムのように伸びる性質があります。
酸素の同素体には、O2 と表される酸素と、O3 と表されるオゾンがあります。
酸素 ( O2 ) は空気中に約 20 %含まれている、無色無臭の気体です。
オゾン ( O3 ) は空気中にごくわずかに存在する、淡青色で特異臭のある気体です。成層圏にはオゾン濃度の高いオゾン層がみられます。
1 〇 ダイヤモンドは炭素の同素体です。
2 〇 炭素の同素体のうち、黒鉛は電気をよく通します。
3 〇 リンの同素体には黄リン、赤リン、黒リンがあります。
4 〇 硫黄の同素体にはゴム状硫黄があります。
5 × 酸素の同素体には、酸素 ( O2 ) とオゾン ( O3 ) があります。
問2 正解 2
原子番号 20 の Ca まで、周期表の配置を覚えていないと解けない問題です。
原子番号順に元素を 20 個語呂合わせで覚えておくか、周期表の配置としてそのまま記憶しておく必要があります。
センター試験に出題されているので、最低限の知識として、水素 H から カルシウム Ca までの周期表の配列を習得することが求められているようです。
元素記号の左上の数字は質量数を表します。
質量数 = 陽子の数 + 中性子の数
ですから、求める中性子の数は、質量数と陽子の数の差になります。
中性子の数 = 質量数 - 陽子の数
Cl の原子番号は 17(つまり陽子の数は 17 )、Ar の原子番号は 18(陽子の数 18 )、K の原子番号は 19(陽子の数 19 )、Ca の原子番号は 20(陽子の数 20 )です。
これより、①の質量数 38 の Ar の中性子の数は 20 個です。
同様に、
②質量数 40 の Ar は中性子 22 個
③質量数 40 の Ca は中性子 20 個
④質量数 37 の Cl は中性子 20 個
⑤質量数 39 の K は中性子 20 個
⑥質量数 40 の K は中性子 21 個
です。
問3 正解 3
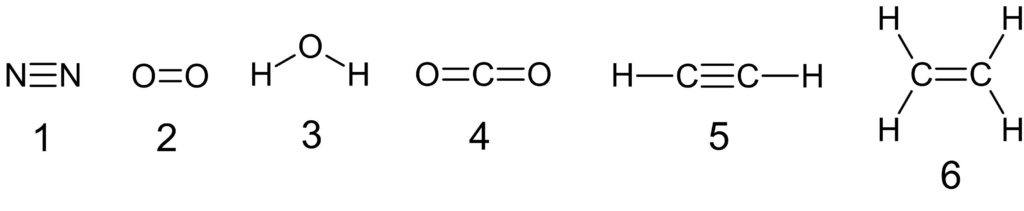
分子内に単結合しかないものを探します。二重結合や三重結合がある選択肢を除きます。
1 × 窒素原子 N は、不対電子を 3 個もつので(原子価が 3 )、N からは共有結合の価標が 3 つ出ています。
窒素原子 N が 2 個あるので、これらは共有結合を 3 つつくって三重結合になります。
2 × 酸素原子 O は、不対電子を 2 個もつので(原子価が 2 )、O からは共有結合の価標が 2 つ出ています。
酸素原子 O が 2 個あるので、これらは共有結合を 2 つつくって二重結合になります。
3 〇 酸素原子 O は、不対電子を 2 個もつので(原子価が 2 )、O からは共有結合の価標が 2 つ出ています。
水素原子 H は、不対電子を 1 個もつので(原子価が 1 )、H からは共有結合の価標が 1 つ出ています。
水素原子 H が 2 個、酸素原子 O が 1 個あるので、水素原子と酸素原子の間で共有結合を 2 つつくります。
この 2 つの共有結合は単結合です。
4 × 酸素原子 O は、不対電子を 2 個もつので(原子価が 2 )、O からは共有結合の価標が 2 つ出ています。
炭素原子 C は、不対電子を 4 個もつので(原子価が 4 )、C からは共有結合の価標が 4 つ出ています。
炭素原子 C が 1 個、酸素原子 O が 2 個あるので、炭素原子と酸素原子の間で二重結合をつくります。
CO2 分子内には二重結合が 2 つできます。
5 × 炭素原子 C は、不対電子を 4 個もつので(原子価が 4 )、C からは共有結合の価標が 4 つ出ています。
水素原子 H は、不対電子を 1 個もつので(原子価が 1 )、H からは共有結合の価標が 1 つ出ています。
炭素原子 C が 2 個、水素原子 H が 2 個あります。
炭素原子と水素原子の間で、共有結合を 2 つつくります。この 2 つの共有結合は単結合です。
炭素原子と炭素原子の間で、共有結合を 3 つつくります。これは三重結合になります。
6 × 炭素原子 C は、不対電子を 4 個もつので(原子価が 4 )、C からは共有結合の価標が 4 つ出ています。
水素原子 H は、不対電子を 1 個もつので(原子価が 1 )、H からは共有結合の価標が 1 つ出ています。
炭素原子 C が 2 個、水素原子 H が 4 個あります。
炭素原子と水素原子の間で、共有結合を 4 つつくります。この 4 つの共有結合は単結合です。
炭素原子と炭素原子の間で、共有結合を 2 つつくります。これは二重結合になります。
分子の構造式は次の通りです。単結合だけでできている分子は水 H2O です。
問4 正解 a 1 b 3
a
二酸化ケイ素 SiO2 は共有結合でできた結晶です。それ以外は以下のように、すべてイオン同士が電気的な引力で結晶を作っています。
硝酸ナトリウム Na+ と NO3- 、塩化銀 Ag+ と Cl- 、硫酸アンモニウム NH4+ と SO42- 、酸化カルシウム Ca2+ と O2- 、炭酸カルシウム Ca2+ と CO32- 。
b
メタンは正四面体形、水は折れ線形、二酸化炭素は直線形、アンモニアは三角錐形です。
水が折れ線形、アンモニアが三角錐形、メタンが正四面体形となる理由は以下の通りです。
これは分子の中心にある原子から見て、4 つある電子対がなるべく電気的な反発が小さくなるような構造となるためです。
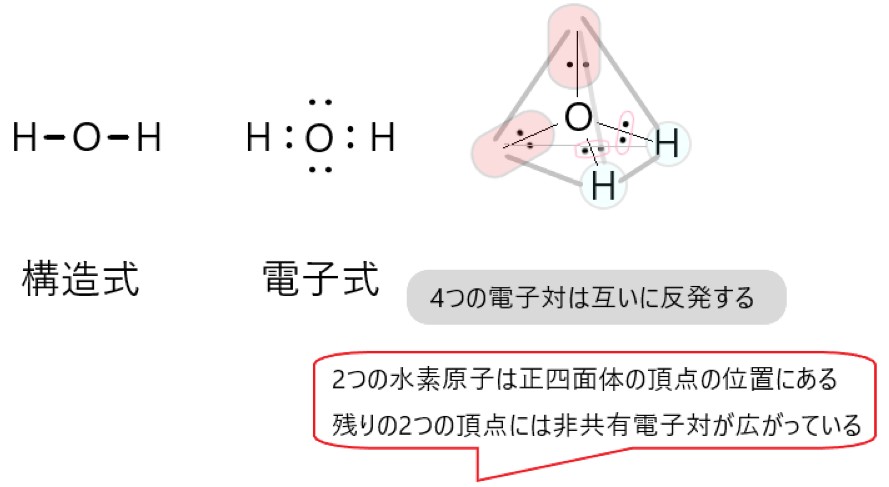
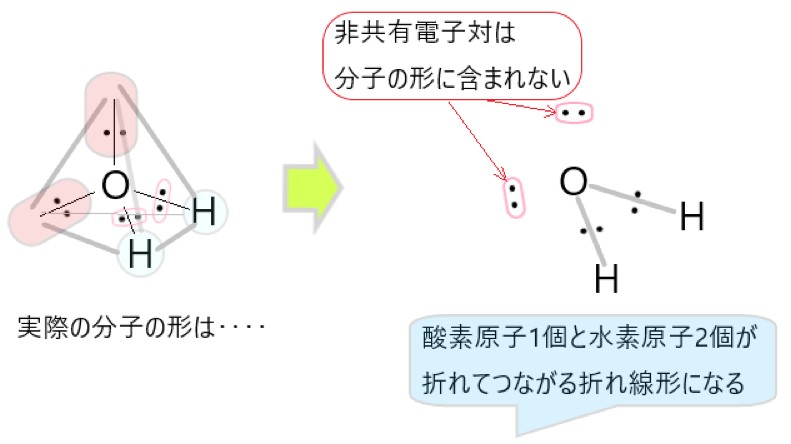
H2O では、分子の中心を酸素原子と考えると、O-H 結合をつくっている共有電子対が 2 個、酸素原子につく非共有電子対が 2 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
しかし、非共有電子対は分子の形としては見えませんので、残るのは中心の酸素原子と、そこから正四面体の頂点方向にある水素原子 2 個です。そこで水分子の形は折れ線形に見えます。
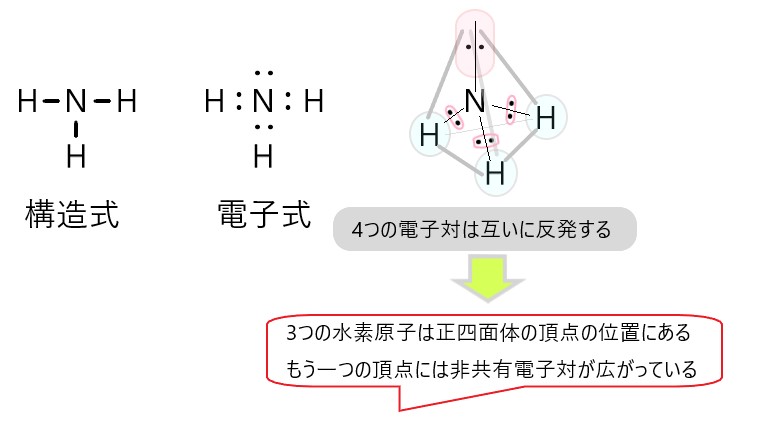
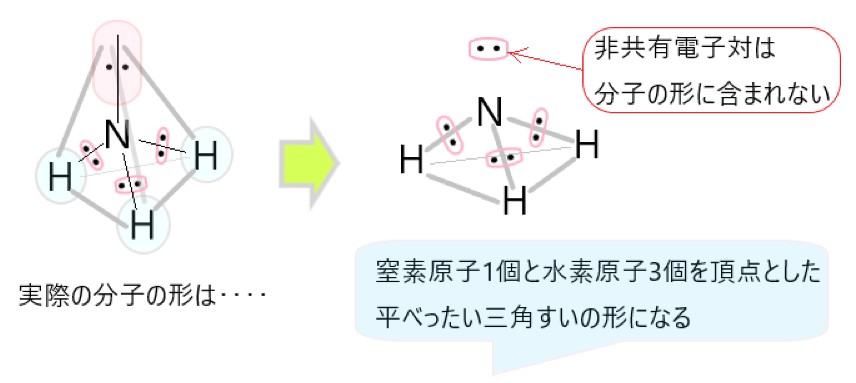
NH3 では、分子の中心を窒素原子と考えると、N-H 結合をつくっている共有電子対が 3 個、窒素原子につく非共有電子対が 1 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
しかし、非共有電子対は分子の形としては見えませんので、残るのは中心の窒素原子と、そこから正四面体の頂点方向にある水素原子 3 個です。そこでアンモニアの形は三角錐形に見えます。
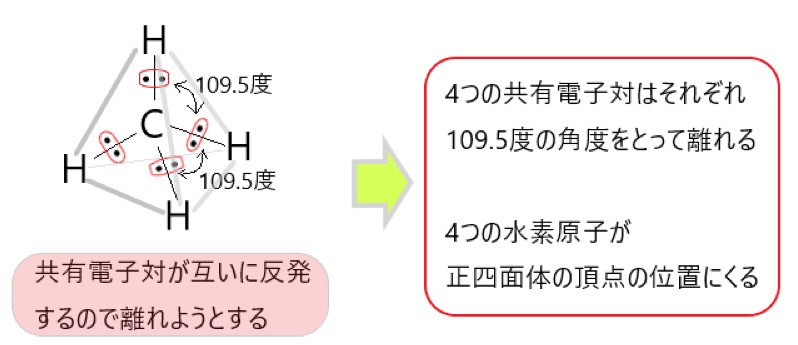
CH4 では、分子の中心を炭素原子と考えると、C-H 結合をつくっている共有電子対が 4 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
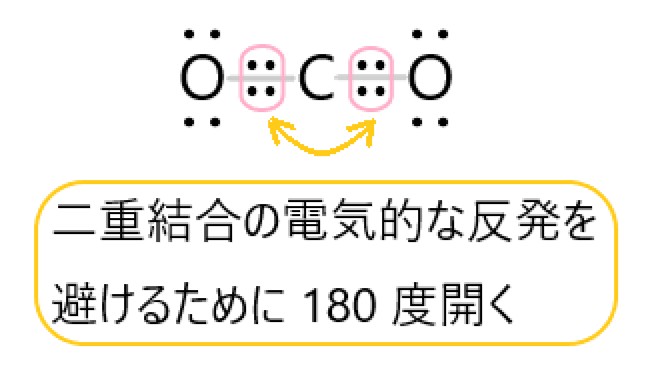
二酸化炭素が直線形となる理由は以下の通りです。
CO2 では、炭素原子と酸素原子は二重結合をつくります。
分子の中心を炭素原子と考えると、この二重結合が炭素原子を挟んで正反対の位置にあるので、分子全体では直線形になります。
炭素原子のまわりには二重結合の電子の塊が 2 つあるので、これらの反発が最も小さくなるのが直線形です。
問5 正解 3
1 〇 気体になっている分子(粒子)は、激しく熱運動をしています。そのため、気体分子は空間の中を飛び回っています。気体の分子同士は遠くに離れています。
液体の分子(粒子)は、気体のときほど激しく熱運動をしないので、分子は全体がまとまって一定の体積になっています。
液体の分子は、限られた体積の液体の中で動いています。したがって、気体より液体の方が分子同士の距離は近いです。
2 〇 液体中の分子は、熱運動で不規則に動いています。それぞれの分子が不規則に動くので、位置も変わります。
3 × この問題はまだ学習していない内容ですが、他の選択肢の正誤は判別できるはずです。
(液体が沸騰し気体になる温度である)沸点とはどういうことか、を知っている必要があります。
液体の蒸気圧が大気圧と等しくなったときに、沸騰が始まり液体は気体になります。液体の表面だけでなく、液体の内側からも分子が気体となる状態が沸騰です。
(ただし沸騰していない液体の状態でも、液体の表面から蒸発してゆっくりと気体になっています。)
液体の蒸気圧と大気圧が等しくなる温度が沸点なので、大気圧が変わると沸点の温度も変わります。
例えば、水は一般に 100 ℃が沸点ですが、高い山の上など大気圧の低い場所では 100 ℃より沸点は低くなります。
4 〇 固体から気体に直接状態が変化することを、昇華といいます。二酸化炭素(ドライアイス)やヨウ素 I2 などは、固体から気体に昇華します。
5 〇 沸騰していなくても、液体の表面から液体の分子は蒸発して気体になっています。グラスに水を入れておいても、長時間放置すれば蒸発して水がなくなる例からわかるでしょう。
問6 正解 6
実験で起きた現象は、次のように考えられます。
乾いたフラスコ内にアンモニアが充満しているところに、スポイトから水を少量入れました。
アンモニアは非常に水に溶けやすいので、スポイトから入れた水にアンモニア気体の一部が溶け、フラスコ内の圧力が下がってビーカーの水を吸い上げました。
1 〇 アンモニア NH3 の分子量は 17 で、平均分子量が約 28.8 の空気より軽いです。また空気より軽いアンモニアは水に溶けやすいので、上方置換法で捕集します。
2 〇 ゴム栓の隙間から空気が入ると、フラスコ内の圧力が下がらず、水を吸い上げない可能性があります。
3 〇 アンモニアの量が少ないと、フラスコ内の圧力の下がり方が小さく、あまり水を吸い上げません。
4 〇 フラスコ内が水でぬれていると、はじめからアンモニアがフラスコ内の水滴に溶けて、アンモニアが減ってしまいます。
5 〇 フラスコ内に噴き上がった水にアンモニアが溶けると、水は塩基性になります。ブロモチモールブルー溶液は塩基性で青くなるので、水は青くなります。
6 × メタンは水にほとんど溶けないので、スポイトで水を入れてもフラスコ内の圧力は変わらず、水を吸い上げません。
問7 正解 3
1 〇 アルミニウムはボーキサイトから電気分解によって製錬されますが、このとき大量の電力を消費します。リサイクルした場合、必要なエネルギーは製錬の約 3 %とされています。
2 〇 空気中の酸素で酸化されるのを防ぎます。
3 × 水道水に塩素が含まれているのは、殺菌のためです。塩素を水に溶かすと、殺菌・漂白作用のある次亜塩素酸が生成します。
Cl2 + H2O → HCl + HClO
4 〇 プラスチックは耐久性や耐食性が非常に高いので、自然界ではほとんど分解されません。
5 〇 雨水には空気中の二酸化炭素が溶けており、雨水に十分量の二酸化炭素が溶けたときの pH は約 5.6 となっています。
6 〇 洗剤には水になじみやすい部分(親水基)と油になじみやすい部分(疎水基)があり、油汚れを疎水基が取り込んで汚れを落とします。
第2問
問1 正解 1
1 × 気体の水素分子は H2 であり、分子量は 2.0 です。気体のヘリウム分子は He であり、分子量は 4.0 です。したがって、4 L の H2 は 2 L の He と同じ重さです。
H2 の質量 = \(\frac{4[L]}{22.4[L]}\) × 2.0[g/mol]
He の質量 = \(\frac{1[L]}{22.4[L]}\) × 4.0[g/mol]
4 L の水素 H2 の方が、1 L のヘリウム He より重くなります。
2 〇 メタン CH4 の分子量は 16 です。16 g のメタンの物質量は 1.0 mol になります。
メタン 1 分子に水素原子は 4 個あるので、メタン 1.0 mol には水素原子が 4.0 mol あります。
3 〇 水 100 g に塩化ナトリウム 25 g を溶かした溶液の質量は 125 g です。質量パーセント濃度は次のように計算できます。
\(\displaystyle\frac{25}{(100 + 25)}\) × 100 = 20%
4 〇 水溶液 100 mL に水酸化ナトリウム 4.0 g が溶けているので、この水溶液 1000 mL には水酸化ナトリウムが 40 g 溶けています。
4.0[g] × \(\displaystyle\frac{1000}{100}\) = 40[g]
水酸化ナトリウムの式量(モル質量)は 40 なので、水溶液のモル濃度は
\(\displaystyle\frac{40[g]}{40[g/mol]}\) = 1.0[mol/L]
問2 正解 2
物質 A の質量が w [ g] でモル質量が M [ g/mol ] なので、
物質 A の物質量は \(\frac{w[g]}{M[g/mol]}\) です。
物質 A が \(\frac{w}{M}\) モルあることがわかったので、
物質 A の分子の数は、\(\frac{w}{M}\) × NA [個] となります。
分子 1 個の断面積と分子の数の積が、膜の全体の面積になります。
s × \(\frac{w}{M}\) × NA = X
式を変形すると
s = \(\displaystyle\frac{XM}{wN_A}\)
問3 正解 2
完全燃焼なので、酸素と反応して二酸化炭素と水が発生します。
C2H5OH + 3 O2 → 2 CO2 + 3 H2O
1 mol のエタノールから 2 mol の二酸化炭素が発生します。
CO2 の分子量は 44 なので、44 g の二酸化炭素の物質量は 1.0 mol です。
つまりエタノールは 0.50 mol 反応しています。
エタノールの分子量は 46 ですから、 0.50 mol の質量は
46[g/mol] × 0.50[mol] = 23[g]
燃焼したエタノールの質量は 23 g です。
問4 正解 a 4 b 4
a
器具の名称は、1 はこまごめピペット、2 はビュレット、3 はメスシリンダー、4 はホールピペット、5 はメスフラスコです。
それぞれの器具の用途は、
1 は大体の量の液体を滴下(正確には測定できない)
2 は正確な量の液体を滴下(滴定実験で用いる)
3 は液体の大まかな体積を測定する(正確には測定できない)
4 は決められた正確な量の液体をはかりとる(そのあとビーカーやメスフラスコなど別の容器に移す)
5 は決められた正確な量の液体をつくる(メスフラスコ内に正確にはかりとった液体を入れ、蒸留水などを加えて決められた正確な体積の溶液とする)
などです。
b
操作Ⅰ
ホールピペット内を純水ですすぎ、水滴がついたまま溶液をはかりとると、はかりとる溶液の濃度が薄まってしまいます。そのため、同じ溶液ですすぎます。
操作Ⅱ
メスフラスコの標線と、溶液の液面のくぼんで平らになった線を合わせます。
(参考)
容器に液体を入れたときに、液面が屈曲する現象をメニスカスといいます。ガラス容器内の液面を読み取るとき、ガラス器具の標線と液面の底面を合わせます。

ここでは左の A の図のように、下にへこんだ形の液面となります。図の点線のように、液面の底面で数値を読み取ります。

上の画像は、実際のガラス器具内の液面です。やや見にくいですが、液面の底面と目盛り線から、21.00 mL と読み取れます。
問5 正解 5
化合物群の水溶液は以下の通りです。
| アンモニア NH3 | 1 価の弱塩基 |
| 水酸化カリウム KOH | 1 価の強塩基 |
| 水酸化カルシウム Ca(OH)2 | 2 価の強塩基 |
| 酢酸 CH3COOH | 1 価の弱酸 |
| 硝酸 HNO3 | 1 価の強酸 |
0.01 mol/L の A~C の水溶液 100 mL を中和滴定するとき、 0.1 mol/L の塩酸もしくは NaOH 水溶液を使うと、中和に要する液量は 10 mL または 20 mL です。
0.01[mol/L] × \(\frac{100[ml]}{1000[ml]}\) × A~C溶液の価数 = 0.1[mol/L] × \(\frac{10 or 20[ml]}{1000[ml]}\) × 1価
2価の化合物は Ca(OH)2 だけであり、中和に 20 mL 必要なのはこの化合物しかないので、化合物 B は Ca(OH)2 です。
また指示薬を加えたときの様子から、水溶液 A は
フェノールフタレインを用いたとき赤から無色に徐々に変化した
とあるので、
フェノールフタレインの変色域が pH 8.0 ~ 9.8 であることから、中和点までのあいだに水溶液は弱塩基性の領域で徐々に pH が変化した
とわかります。
同時に、メチルオレンジを用いたとき黄から赤に急激に変化した
とあるので、
メチルオレンジの変色域が pH 3.1 ~ 4.4 であることから、中和点付近から中和点を超えたとき、急激に酸性側で pH が変化した
ことがわかります。
まとめると、塩基性側で pH の変化がゆっくりで、中和点付近を過ぎ酸性側で pH の変化が大きくなっています。
これらを考えると、弱塩基に強酸を滴下しているので、化合物 A は NH3 です。
水溶液 C は
フェノールフタレインを用いたとき無色から赤に急激に変化した
とあるので、
フェノールフタレインの変色域が pH 8.0 ~ 9.8 であることから、中和点付近から中和点を超えたとき、塩基性側で急激に pH が変化していることがわかります。
同時に、メチルオレンジを用いたとき赤から黄に徐々に変化した
とあるので、
メチルオレンジの変色域が pH 3.1 ~ 4.4 であることから、中和点までのあいだに水溶液は弱酸性の領域で徐々に pH が変化した
ことがわかります。
まとめると、酸性側で pH の変化がゆっくりで、中和点付近から中和点を超えたとき、 塩基性側で pH の変化が大きくなっています。
これらを考えると、弱酸に強塩基を滴下しているので、化合物 C は CH3COOH です。
問6 正解 6
MnO4- は、中性または塩基性水溶液中で酸化剤としてはたらきます。
このとき、MnO4- の Mn 原子の酸化数は +7 で、MnO2 の Mn 原子の酸化数は +4 です。
反応後に酸化数は 3 減っているので、 Mn 原子が 1 個あたり電子を 3 個受け取り、還元されていることがわかります。
Mn 原子 1 個あたり電子を 3 個受け取るので、b = 3 となります。
そこで Mn の半反応式は
MnO4- + a H2O + 3 e- → MnO2 + 2 a OH-
となります。
この半反応式の酸素原子の数を、両辺で合わせます。
4 + a × 1 = 2 + 2a × 1
これを解くと a = 2 です。
よって半反応式は
MnO4- + 2 H2O + 3 e- → MnO2 + 4 OH-‥‥(A)
電子を消去するためには、金属 M2+ の半反応式を 3 倍して
3 M2+ → 3 M3+ + 3 e-‥‥(B)
とします。
(A)(B)両式を足し合わせれば
MnO4- + 3 M2+ + 2 H2O → MnO2 + 3 M3+ + 4 OH-
となり、⑥と解答できます。
(参考)
なお本問のように、過マンガン酸カリウムは中性・塩基性の条件下でも酸化剤として用いられます。
これまでの学習では、過マンガン酸カリウム水溶液は、硫酸を加えることにより酸性条件としていました。
酸性条件下での過マンガン酸カリウムの半反応式は
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
と表されます。
これに対し、中性・塩基性条件下で過マンガン酸カリウムを酸化剤として用いたときの半反応式は、
MnO4- + 2 H2O + 3 e- → MnO2 + 4 OH-
となります。
問7 正解 4
図 2 からわかるように、炭酸カルシウムの質量が増えると、発生した二酸化炭素の物質量も増えます。
また炭酸カルシウムの質量が 2.5 g のとき、発生した二酸化炭素の物質量は 0.025 mol です。炭酸カルシウムの質量がこれ以上増えても、発生した二酸化炭素の物質量は 0.025 mol のまま一定です。
これより、炭酸カルシウムの質量を 2.5 g まで増やすと、存在する塩酸が完全に反応して、0.025 mol の二酸化炭素が発生したとわかります。
反応式より HCl が 2 mol 反応すると CO2 が 1 mol 発生します。
したがって、存在する HCl の物質量は
0.025 × 2 = 0.050 mol
です。
求める塩酸のモル濃度を X mol/L とすると、塩酸の溶液は 25 mL なので
X[mol/L] × \(\frac{25[mL]}{1000[mL]}\) = 0.050[mol]
これを解くと X = 2.0[mol/L]
