もくじ
第1問
問1 正解 a 2 b 3
a は単体と化合物の組合せなので、1 種類の元素からできている単体と、2 種類以上の元素からできている化合物の組合せを選びます。
b は純物質と混合物の組合せなので、1 種類の物質からなる純物質と、2 種類以上の純物質が含まれている混合物の組合せを選びます。
1 ダイヤモンドと黒鉛は、どちらも炭素元素の単体で C と表されます。単体なのでこれらは純物質です。また、それぞれ同素体の関係です。
2 塩素 Cl2 と塩化ナトリウム NaCl はただ塩素原子が共通なだけで、物質として関係はありません。
塩素は 1 種類の元素からできているので単体で純物質、塩化ナトリウムは 2 種類の元素からできているので化合物で純物質です。
単体と化合物の組合せなので、a に当てはまります。
3 塩化水素 HCl は 2 種類の元素からできているので、化合物で純物質です。
また、塩化水素 HCl を水に溶かしたものを塩酸といいます。
塩酸は、純物質である塩化水素 HCl と水 H2O が任意に混合した(濃度はさまざまな)溶液なので、混合物です。
純物質と混合物の組合せなので、b に当てはまります。
4 メタン CH4 とエタン C2H6 はどちらも似た性質の有機化合物ですが、物質としては関係ありません。
メタンとエタンは 2 種類の元素からできているので、ともに化合物で純物質です。
5 希硫酸は硫酸 H2SO4 を水に(薄めに)溶かした溶液です。
アンモニア水はアンモニア NH3 を水に溶かした溶液です。
どちらも(溶かせる範囲内なら)任意の割合で水と混ぜることができます。
希硫酸は、純物質である硫酸と水を混ぜているので混合物です。アンモニア水は、純物質であるアンモニアと水を混ぜているので混合物です。
問2 正解 4
1 × 非共有電子対は 2 組
窒素原子 N は 15 族元素であり、価電子は(最外殻電子数は) 5 個です。そこで下の電子式のように、電子対が 1 組と不対電子が 3 個あります。
この窒素原子が 2 個結合してできる窒素分子 N2 は、それぞれの不対電子 3 個が共有結合をつくります。
これにより三重結合ができます。それぞれの窒素原子は、3 つの共有結合(三重結合)と 1 つの非共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
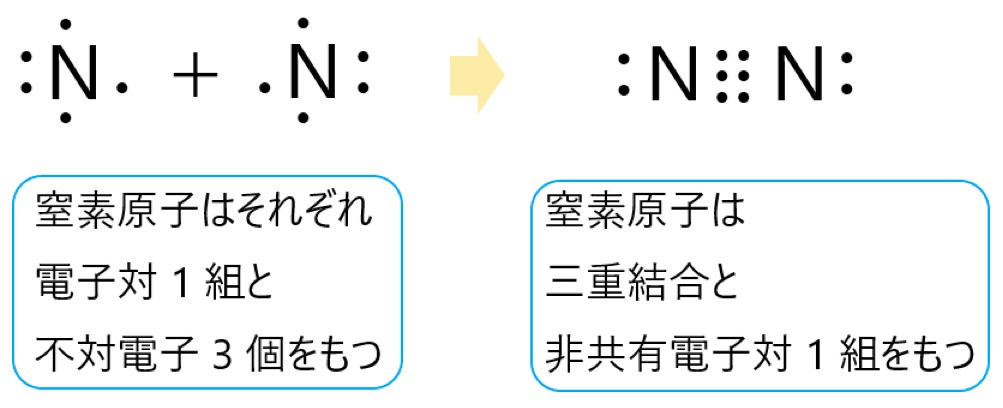
窒素分子 N2 全体では、非共有電子対は 2 組あります。
2 × 非共有電子対は 1 組
窒素原子 N は 15 族元素であり、価電子は(最外殻電子数は) 5 個です。そこで下の電子式のように、電子対が 1 組と不対電子が 3 個あります。
水素原子 H は 1 族元素であり、価電子は(最外殻電子数は) 1 個です。そこで下の電子式のように、不対電子が 1 個あります。

これら窒素原子 1 個と水素原子 3 個から、1 つのアンモニア分子ができます。
窒素原子と水素原子は、それぞれが不対電子を 1 個ずつ出して共有結合をつくります。
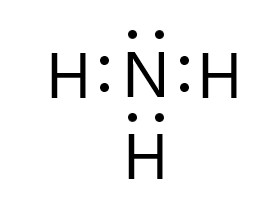
アンモニア分子内の窒素原子は、3 つの共有電子対と 1 つの非共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
アンモニア分子内の水素原子は、1 つの共有電子対があるので、最外殻に 2 個の電子をもつことになり、安定します。
(K 殻に 2 個の電子が入ったヘリウムの電子配置をとると、水素原子は安定します。)
アンモニア分子 NH3 全体では、非共有電子対は 1 組あります。
3 × 非共有電子対は 2 組
酸素原子 O は 16 族元素であり、価電子は(最外殻電子数は) 6 個です。そこで下の電子式のように、電子対が 2 組と不対電子が 2 個あります。
水素原子 H は 1 族元素であり、価電子は(最外殻電子数は) 1 個です。そこで下の電子式のように、不対電子が 1 個あります。

これら酸素原子 1 個と水素原子 2 個から、1 つの水分子ができます。
酸素原子と水素原子は、それぞれが不対電子を 1 個ずつ出して共有結合をつくります。
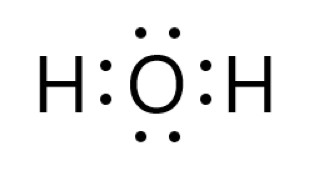
水分子内の酸素原子は、2 つの共有電子対と 2 つの非共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
水分子内の水素原子は、1 つの共有電子対があるので、最外殻に 2 個の電子をもつことになり、安定します。
(K 殻に 2 個の電子が入ったヘリウムの電子配置をとると、水素原子は安定します。)
水分子 H2O 全体では、非共有電子対は 2 組あります。
4 〇 非共有電子対は 6 組
塩素原子 Cl は 17 族元素であり、価電子は(最外殻電子数は) 7 個です。そこで下の電子式のように、電子対が 3 組と不対電子が 1 個あります。
この塩素原子が 2 個結合してできる塩素分子 Cl2 は、それぞれの不対電子 1 個が共有結合をつくります。
それぞれの塩素原子は、1 つの共有結合と 3 つの非共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
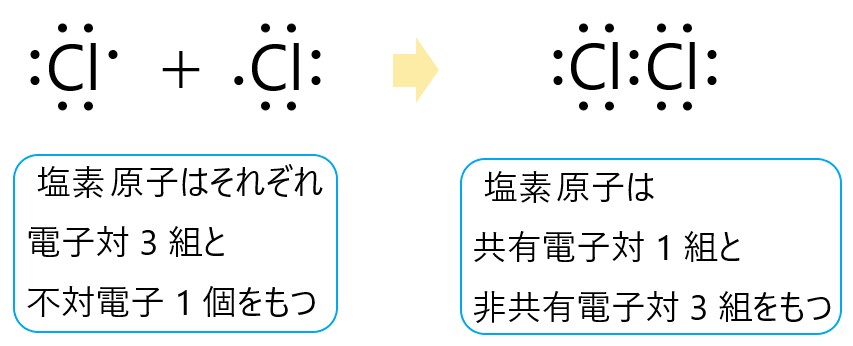
塩素分子 Cl2 全体では、非共有電子対は 6 組あります。
5 × 非共有電子対は無い
炭素原子 C は 14 族元素であり、価電子は(最外殻電子数は) 4 個です。そこで下の電子式のように、不対電子が 4 個あります。
水素原子 H は 1 族元素であり、価電子は(最外殻電子数は) 1 個です。そこで下の電子式のように、不対電子が 1 個あります。
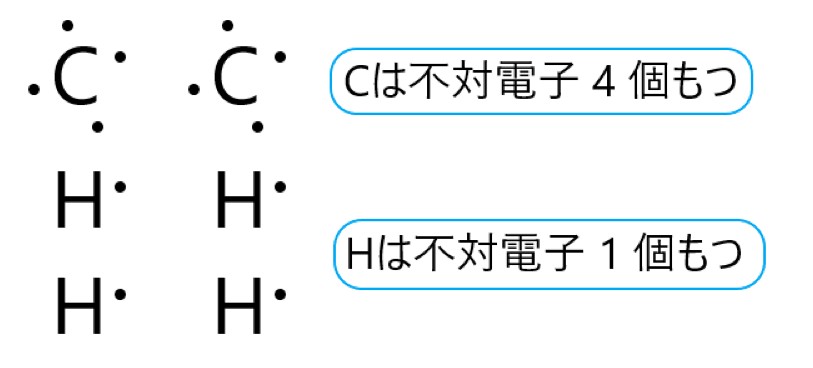
これら炭素原子 2 個と水素原子 4 個から、1 つのエチレン分子ができます。
炭素原子同士は 2 つの共有結合(二重結合)をつくります。炭素原子と水素原子は、それぞれが不対電子を 1 個ずつ出して共有結合をつくります。
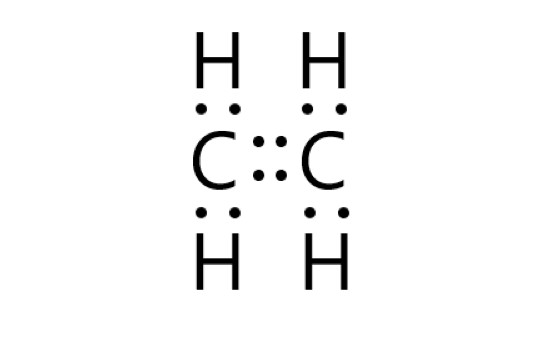
エチレン分子内の炭素原子は、1 つの二重結合と 2 つの共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
エチレン分子内の水素原子は、1 つの共有電子対があるので、最外殻に 2 個の電子をもつことになり、安定します。
(K 殻に 2 個の電子が入ったヘリウムの電子配置をとると、水素原子は安定します。)
エチレン分子内の電子対はすべて共有結合に使われており、6 個の共有電子対があります。エチレン分子には非共有電子対はありません。
まとめると、以下の電子式のようになります。
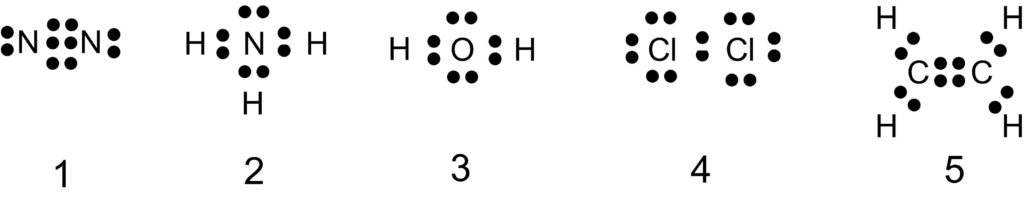
非共有電子対の数は、1 は 2 個、2 は 1 個、3 は 2 個、4 は 6 個、5 は 0 個です。
問3 正解 4
原子番号が増えていくとき、価電子はどう変化するのかという問題です。
まずはじめに、原子番号とその原子がもつ陽子の数は等しいことを思い出します。また、原子がもつ陽子の数と電子の数は等しいことを考えます。
つまり原子がもつ電子が 1 個ずつ増えていくと、価電子はどうなるのかを調べます。
価電子は、最外殻の電子数と一致します。ただし、希ガス元素のときは価電子は 0 です。
そこで、原子番号が増えて原子のもつ電子数が増加していくと、その電子配置はどうなるのか(最外殻の電子数はいくつか)を考えれば、この問題を解けます。
グラフは原子番号 20 までなので、原子番号 1 の水素原子から、原子番号 20 のカルシウム原子までの電子配置を考えます。
そしてそれぞれの価電子を決めれば、正しいグラフを選ぶことができます。
以下は原子番号 1 の水素原子から原子番号 20 のカルシウム原子までの電子配置の表です。
| 原子 | 原子番号 | K殻 | L殻 | M殻 | N殻 | 価電子 |
| 水素 H | 1 | 1 | 1 | |||
| ヘリウム He | 2 | 2 | 0 | |||
| リチウム Li | 3 | 2 | 1 | 1 | ||
| ベリリウム Be | 4 | 2 | 2 | 2 | ||
| ホウ素 B | 5 | 2 | 3 | 3 | ||
| 炭素 C | 6 | 2 | 4 | 4 | ||
| 窒素 N | 7 | 2 | 5 | 5 | ||
| 酸素 O | 8 | 2 | 6 | 6 | ||
| フッ素 F | 9 | 2 | 7 | 7 | ||
| ネオン Ne | 10 | 2 | 8 | 0 | ||
| ナトリウム Na | 11 | 2 | 8 | 1 | 1 | |
| マグネシウム Mg | 12 | 2 | 8 | 2 | 2 | |
| アルミニウム Al | 13 | 2 | 8 | 3 | 3 | |
| ケイ素 Si | 14 | 2 | 8 | 4 | 4 | |
| リン P | 15 | 2 | 8 | 5 | 5 | |
| 硫黄 S | 16 | 2 | 8 | 6 | 6 | |
| 塩素 Cl | 17 | 2 | 8 | 7 | 7 | |
| アルゴン Ar | 18 | 2 | 8 | 8 | 0 | |
| カリウム K | 19 | 2 | 8 | 8 | 1 | 1 |
| カルシウム Ca | 20 | 2 | 8 | 8 | 2 | 2 |
原子番号 1 の H は K 殻に電子が 1 個入り、最外殻電子数が 1 なので価電子は 1 となります。
原子番号 2 の He は K 殻に電子が 2 個入り、K 殻が電子で埋まり閉殻となります。He は希ガスと呼ばれる元素なので、価電子は 0 となります。
原子番号 3 の Li から原子番号 10 の Ne までは、電子は L 殻に入ります。
原子番号 3 の Li は K 殻に電子が 2 個入り、次の電子は L 殻に 1 個入ります。最外殻電子は L 殻の 1 個なので、価電子は 1 となります。
同様に原子番号 4 の Be は K 殻に電子が 2 個入り、次の電子は L 殻に 2 個入ります。最外殻電子は L 殻の 2 個なので、価電子は 2 となります。
原子番号 9 の F までは、同じように価電子が 1 ずつ増えていきます。
原子番号 10 の Ne は、K 殻に電子が 2 個入り、次の電子は L 殻に 8 個入ります。最外殻電子は L 殻の 8 個で、L 殻はすべて埋まり閉殻となります。
Ne は希ガスと呼ばれる元素で、L 殻に電子が 8 個入り閉殻なので、価電子は 0 です。
原子番号 11 の Na から原子番号 18 の Ar までは、電子は M 殻に入ります。
原子番号 11 の Na は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 1 個入ります。最外殻電子は M 殻の 1 個なので、価電子は 1 となります。
同様に原子番号 12 の Mg は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 2 個入ります。最外殻電子は M 殻の 2 個なので、価電子は 2 となります。
原子番号 17 の Cl までは、同じように価電子が 1 ずつ増えていきます。
原子番号 18 の Ar は、K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 8 個入ります。最外殻電子は M 殻の 8 個です。
最外殻の電子数が 8 個になると、原子は安定します。Ar は希ガスと呼ばれる元素で、M 殻に電子が 8 個入っているので、価電子は 0 です。
原子番号 19 の K から原子番号 20 の Ca までは、電子は N 殻に入ります。
原子番号 19 の K は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 8 個、さらに次の電子は N 殻に 1 個入ります。最外殻電子は N 殻の 1 個なので、価電子は 1 となります。
同様に原子番号 20 の Ca は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 8 個、さらに次の電子は N 殻に 2 個入ります。最外殻電子は N 殻の 2 個なので、価電子は 2 となります。
以上の結果をまとめると、正しいグラフは④となります。
問4 正解 2
気体の種類によらず、0 ℃で 1.013 × 105 Pa の条件下なら、物質量 1 mol の気体の体積は 22.4 L です。
気体の種類によらず体積は等しいので、1 mol の質量が大きいほど気体の密度は大きくなります。
1 mol の質量が大きくなるのは分子量が大きいときなので、それぞれの気体の分子量を比較します。
空気の分子量の値と近い分子量をもつ気体は、空気の密度に近くなります。
なお、空気は窒素 80 %、酸素 20 %の混合気体なので、その平均分子量は
14 × 2 × 0.80 + 16 × 2 × 0.20 = 28.8
28.8 となります。
各選択肢の気体の分子量は
1 アルゴンは 1 原子で気体分子となります。そのため、原子量 = 分子量 = 40
2 一酸化窒素 NO の分子量は 14 + 16 = 30
3 オゾン O3 の分子量は 16 × 3 = 48
4 二酸化硫黄 SO2 の分子量は 32 + 16 × 2 = 64
5 二酸化炭素 CO2 の分子量は 12 + 16 × 2 = 44
最も空気の分子量に近いのは、②の一酸化窒素です。
問5 正解 6
実験Ⅰ
塩化カルシウム CaCl2 とグルコース C6H12O6 は水に溶けますが、二酸化ケイ素 SiO2 は水に溶けません。
実験Ⅱ
塩化カルシウムは水溶液中で電離して、Ca2+ イオンと Cl- イオンになります。これらの電解質があるので、塩化カルシウム水溶液は電気を通します。
グルコースは水溶液中で電離しないので、グルコース水溶液は電気をほとんど通しません。
問6 正解 2
弱塩基の塩の塩化アンモニウム NH4Cl に強塩基の水酸化ナトリウム NaOH を加えると
NH4Cl + NaOH → NaCl + NH3 + H2O
のように弱塩基であるアンモニアが遊離します。
このとき 1 mol の塩化アンモニウムが反応すると、1 mol のアンモニアが生成します。
質量パーセント濃度 5.35 % の水溶液 100 g には、溶質(塩化アンモニウム)は
100[g] × \(\frac{5.35}{100}\) = 5.35[g]
含まれます。
塩化アンモニウムのモル質量は 14 + 1.0 × 4 + 35.5 = 53.5[g/mol] なので、
反応した塩化アンモニウムの物質量は
\(\frac{5.35[g]}{53.5[g/mol]}\) = 0.100[mol]
したがって、生成したアンモニアも 0.100 mol です。
アンモニアのモル質量は 14 + 1.0 × 3 = 17[g/mol] であるので、求めるアンモニアの質量は
17[g/mol] × 0.100[mol] = 1.7[g]
問7 正解 5
1 〇 青銅(ブロンズ)は銅とスズの合金です。
2 〇 アルミニウムは密度の小さい金属で、合金の材料に使われます。ジュラルミンはアルミニウムのほか銅やマグネシウムなどが含まれる合金です。
3 〇 鉄は湿った空気中で赤褐色にさびて酸化鉄(Ⅲ) Fe2O3 となります。
4 〇 金は化学的に安定した金属です。
5 × 銀は電気や熱を伝えやすい金属です。
第2問
問1 正解 3
1 × メスシリンダーでは正確な体積をはかれないので、メスフラスコを使います。
2 × こまごめピペット、メスシリンダーともに正確な体積をはかることはできません。
3 〇 正確な体積をはかりとるには、ホールピペットとメスフラスコが必要です。
4 × こまごめピペットでは正確な体積をはかりとれません。
問2 正解 1
まずはじめに、エタノールの分子量を求めます。
エタノール C2H5OH の分子量は、分子を構成する原子の原子量の総和として計算できるので、
12 × 2 + 1.0 × 6 + 16 = 46 です。
次に、9.2 g のエタノールは何モルなのかを計算します。
エタノールの分子量が 46 なので、エタノールのモル質量は 46 g/mol です。
9.2 g のエタノールの物質量は
\(\frac{9.2[g]}{46[g/mol]}\) = 0.20[mol]
エタノールが 0.20 mol あることがわかりました。またアボガドロ定数の定義より、6.0 × 1023 個の粒子が集まると、1 mol となります。
分子数を求めるのでアボガドロ定数をかけると
0.20[mol] × 6.0 × 1023[/mol]
= 1.2 × 1023[個]
エタノール分子は 1.2 × 1023 個あるとわかりました。
問3 正解 2
水が酸としてはたらくということは、化学反応式の左辺にある H2O が相手に H+ を与えて、右辺で OH- が生成していることになります。
左辺の H2O が相手に H+ を与えて自身が OH-となっているのは、ウとオです。
また、化学反応式で使われている ⇄ は、化学反応が左から右、あるいは右から左のどちらにも進むことを示しています。
( → のときは、化学反応が左から右だけに進み、反応物から生成物が生じます。)
ただし本問では、特に気にすることなく、左辺の水 H2O が H+ を相手に与えるかどうかだけを考えれば解けます。
ア × H2O は塩化水素 HCl から水素イオン H+ を受け取っているので、塩基としてはたらいています。
イ × H2O は硝酸 HNO3 から水素イオン H+ を受け取っているので、塩基としてはたらいています。
ウ 〇 H2O は水素イオン H+ を相手(酢酸イオン CH3COO-)に与えているので、酸としてはたらいています。
エ × H2O は酢酸 CH3COOH から水素イオン H+ を受け取っているので、塩基としてはたらいています。
オ 〇 H2O は水素イオン H+ を相手(炭酸イオン CO32-)に与えているので、酸としてはたらいています。
問4 正解 a 4 b 4
a
酸化数は -1 から 0 へと変化します。
H2O2 では H の酸化数 が +1 で、O の酸化数は -1 、H2O2 全体の酸化数は 0 です。
(過酸化水素 H2O2 の酸素原子の酸化数は、-2 ではなく例外的に -1 です。)
O2 は単体なので、分子全体では酸化数は 0 。したがって O の酸化数は 0 です。
b
2つの半反応式の両辺を加えて、反応式を導きます。
(1)式 × 2 + (2)式 × 5 より
2 MnO4- + 5 H2O2 + 6 H+ → 2 Mn2+ + 5 O2 + 8 H2O
グラフより、過マンガン酸カリウムが 0.10 mol あるときに反応が完了しています。
過マンガン酸イオン 2 mol と過酸化水素 5 mol が反応するので、過マンガン酸カリウム 0.10 mol と反応する過酸化水素は
0.10[mol] × \(\frac{5}{2}\) = 0.25[mol]
したがって、反応前の過酸化水素の物質量 x は 0.25 mol です。
問5 正解 3
1 〇 純水は中性であり pH = 7 なので、純水中の水素イオン濃度は
[ H+ ] = [ OH-] = 1.0 × 10-7 mol/L
です。
強酸を純水で希釈していくと、水素イオン濃度は 1.0 × 10-7 mol/L に近づきます。
強酸を純水で希釈しても、中性を超えて塩基性になることはありません。
2 〇 pH の定義は
$$[H^+] = 1 × 10^{-pH}[mol/L]$$
です。
3 × 0.010 mol/L の塩酸は 1 価の強酸でほぼ電離するので、電離度を 1 とすると
[H+] = 0.010 mol/L × 1 = 1.0 × 10-2 mol/L です。0.010 mol/L の硫酸は 2 価の強酸で、ほとんど完全に電離します。
水素イオン H+ は、硫酸 1 分子から 2 つ生成するので、電離度をほぼ 1 とすると
[H+] ≒ 0.010 mol/L × 2 × 1 = 2.0 × 10-2 mol/L です。このように同濃度の塩酸と硫酸では、硫酸が 2 価の強酸であることから、硫酸の水素イオン濃度の方が高くなります。
4 〇 KOH は 1 価の強塩基です。(アルカリ金属の水酸化物は強塩基です。)
問6 正解 1
1 × 電子の授受だけでも酸化還元反応は起こります。
例えばヨウ化カリウムと塩素の反応では、酸素原子も水素原子も存在しませんが、酸化還元反応が起きています。
2 KI + Cl2 → 2 KCl + I2
I は酸化され、酸化数は -1 から 0 と変わります。
Cl は還元され、酸化数は 0 から -1 へと変わります。
2 〇 O3 + 2 H+ + 2 e- → O2 + H2O
オゾン O3 は酸化剤としてはたらくと、O2 と H2O に変化します。
オゾンは酸化剤としてはたらいたとき、反応後の H2O 酸素原子の酸化数は 0 から -2 と変化します。(単体の O2 の酸素原子は酸化数 0 のままです。)
3 〇 C2H2O4 → 2 CO2 + 2 H+ + 2 e-
あるいは (COOH)2 → 2 CO2 + 2 H+ + 2 e-
シュウ酸 C2H2O4 は還元剤としてはたらくと、CO2 に変化します。
シュウ酸は還元剤としてはたらいたとき、炭素原子の酸化数は +3 から +4 と変化します。
4 〇 二酸化硫黄 SO2 の硫黄原子の酸化数は +4 です。
酸化剤としてはたらく場合は、酸化数 0 の S に還元されます。
SO2 + 4 H+ + 4 e- → S + 2 H2O
還元剤としてはたらく場合は、酸化数 +6 の SO42- に酸化されます。
SO2 + 2 H2O → SO42- + 4 H+ + 2 e-
問7 正解 6
イオン化傾向の大きい金属は、水溶液中で陽イオンとなりやすいです。
イオン化傾向の大きな金属の板を、それよりイオン化傾向の小さい金属イオンが含まれる溶液に浸すと、イオン化傾向の大きな金属が溶けてイオンとなり溶液中に拡散します。
このとき金属が溶けて陽イオンとなるので、そのとき放出された電子を受け取って、水溶液中のイオン化傾向の小さい金属イオンが金属として析出します。
金属 A の板を水溶液に浸すと、Cu2+ 、Pb2+ 、Sn2+ 、いずれの陽イオンも析出しています。そこで、金属 A はそれらよりイオン化傾向の大きい Zn とわかります。
金属 B の板を水溶液に浸すと、Ag+ イオンが金属として析出し、Pb2+ と Sn2+ の 2 つのイオンは金属として析出しませんでした。
これより、金属 B は Pb と Sn よりイオン化傾向は小さく、Ag よりはイオン化傾向が大きいことがわかります。以上より、金属 B は Cu です。
