もくじ
第1問
問1 a 5 b 1
a
図 1 の電子式から、この原子 A は最外殻に電子を 5 個もっていることがわかります。
そこで、①~⑥の元素のうち、最外殻の電子が 5 個のものを探します。
1 × 酸素は原子番号 8 であり、陽子と電子の数は 8 個です。電子は K 殻に 2 個、L 殻に 6 個です。最外殻の電子数は 6 です。
2 × フッ素は原子番号 9 であり、陽子と電子の数は 9 個です。電子は K 殻に 2 個、L 殻に 7 個です。最外殻の電子数は 7 です。
3 × アルミニウムは原子番号 13 であり、陽子と電子の数は 13 個です。電子は K 殻に 2 個、L 殻に 8 個、M 殻に 3 個です。最外殻の電子数は 3 です。
4 × ケイ素は原子番号 14 であり、陽子と電子の数は 14 個です。電子は K 殻に 2 個、L 殻に 8 個、M 殻に 4 個です。最外殻の電子数は 4 です。
5 〇 リンは原子番号 15 であり、陽子と電子の数は 15 個です。電子は K 殻に 2 個、L 殻に 8 個、M 殻に 5 個です。最外殻の電子数は 5 です。
リンの原子は最外殻に電子を 5 個もつので、電子式で表すと図 1 のようになります。
6 × アルゴンは原子番号 18 であり、陽子と電子の数は 18 個です。電子は K 殻に 2 個、L 殻に 8 個、M 殻に 8 個です。最外殻の電子数は 8 です。
b
この銅イオン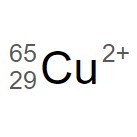 は、原子番号 29(陽子の数 29 )で質量数が 65 である、2 価の陽イオンです。
は、原子番号 29(陽子の数 29 )で質量数が 65 である、2 価の陽イオンです。
陽子の数が 29 なので電子の数も 29 ですが、2 価の陽イオンとなっているので 2 個の電子を失っています。そこで、電子の数は 27 となります。
問2 4
1 〇
この酸素原子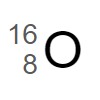 は原子番号 8(陽子の数 8 )で、質量数が 16 です。
は原子番号 8(陽子の数 8 )で、質量数が 16 です。
質量数 = 陽子の数 + 中性子の数
ですから、中性子の数は 8 です。
2 〇
この2つの炭素原子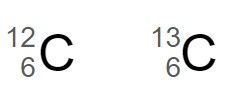 は、中性子の数が 1 異なる同位体です。
は、中性子の数が 1 異なる同位体です。
左の炭素原子は質量数 12 で原子番号 6 なので、陽子の数と電子の数は 6 個、中性子の数は 6 個です。
右の炭素原子は質量数 13 で原子番号 6 なので、陽子の数と電子の数は 6 個、中性子の数は 7 個です。
中性子の数だけが異なる原子同士は、同位体と呼ばれます。同位体の化学的性質はほとんど同じです。
3 〇 第 2 周期と第 3 周期の同族元素では、原子番号が 8 ずれています。原子番号に 8 だけ差があるので、陽子の数の差も 8 です。
4 × それぞれの原子の質量は、相対質量として表されます。この相対質量は、質量数とほぼ一致します。
そのため、原子の質量は質量数にほぼ比例します。
一方、質量数 = 陽子の数 + 中性子の数
となるので、原子の質量は原子番号(陽子の数)に比例しません。
5 〇 記述のとおり、多くの元素は同位体をもちます。
問3 5
1 〇 オゾン O3 と酸素 O2 は酸素元素の同素体です。
2 〇 ナトリウムは金属です。金属の単体は金属結晶で、結晶内を自由に電子が動けるので電気を通します。
3 〇 硫黄元素の同素体には、斜方硫黄、単斜硫黄、ゴム状硫黄があります。
斜方硫黄と単斜硫黄は黄色の S8 で表される環状分子、ゴム状硫黄は黄~黄褐色の鎖状分子です。
4 〇 水銀の単体は水銀の金属結晶です。水銀は常温常圧で液体の状態となる、ただひとつの金属です。
5 × 塩素の単体は、二原子分子の塩素 Cl2 です。2 つの原子が共有結合しています。
問4 2
まず、イオン結晶の基本的性質について確認しましょう。
陽イオンと陰イオンが規則正しく並んでできた固体を、イオン結晶といいます。
イオン結晶では、陽イオンと陰イオンはクーロン力によってイオン結合し、多数のイオンが配列しています。
イオン結晶は一般に、融点が高く硬いです。しかし、特定の面に沿って割れやすい性質があります。
イオン結晶は、固体のままでは電気を通しません。しかし、融解して液体になると電気を通します。
イオン結晶を水に溶かすと、その水溶液は電気を通します。
イオン結晶は、組成式で表されます。
1 〇 一般にイオン結晶は融点が高いです。
2 × イオン結晶は固体のままでは電気を通しにくいです。溶液に溶けるか、融解して液体になると、電荷を持ったイオンが動ける状態となり電気を通します。
3 〇 硬いですが、力をかけるとイオンの結晶構造がずれて静電気的な引力がなくなり、同じ電荷のイオン同士は反発し、もろくなります。
4 〇 イオン結晶は、陽イオンと陰イオンが規則正しく並んでいます。
5 〇 水に溶かすと陽イオンと陰イオンに電離するので、電気も通します。
問5 4
1 〇 湿った空気中に鉄を放置すると、赤さび Fe2O3 が生じます。
2 〇 銑鉄には炭素が 4 %ほど含まれますが、炭素の含有量を減らすと割れにくい鋼になります。
3 〇 アルミニウムは密度の小さい軽金属です。
4 × アルミニウムは、ボーキサイトから得られる酸化アルミニウムを高温で融解し、電気分解することでつくられます。
5 〇 アルミニウムに銅、マグネシウム、マンガンなどを加えた合金であるジュラルミンは、軽くて強度がある素材です。
問6 5
ろ過の操作では、ビーカーからガラス棒を伝わらせて液体をろうとに流します。ガラス棒はろうとの側面につけて、液体を伝わらせます。
このとき液体が飛び散らないように静かに少しずつ、ろうとの中に敷いてあるろ紙の上に流し込みます。
ろうとから下のビーカーに液体を落とすときも、飛び散らないようにビーカーの側面を伝わらせます。ろうとの足をビーカーの側面につけることで、ろ過を速く進めることができます。
問7 4
固体の水(氷)は 0 ℃ より低い温度で存在し、融点である 0 ℃ で固体から液体に融け始めます。固体がすべて液体になるまで、温度は 0 ℃ のままです。
水がすべて液体になると、加熱とともに温度は 0 ℃ から 100 ℃ まで上昇します。ただし、液体の状態でも液面からは蒸発して、一部の水は気体になります。
そして沸点の 100 ℃ まで加熱すると、沸騰が始まり液体の水は気体になります。このとき、液体の水が残っている間は温度は 100 ℃ を保っています。
すべての水が気体となったあと、加熱すると 100 ℃ より高い温度に上昇していきます。
1 〇 点 A では固体の水のみ存在します。
2 〇 T1 は融点で、0 ℃ です。
3 〇 加熱され氷が完全に融けるまでは、温度は 0 ℃ を保ちます。
4 × T1 は 0 ℃ 、T2 は 100 ℃ です。この間の液体の水の状態でも、液面から蒸発は起こっています。
例えば室温の条件下で置かれたコップの水は、時間がたつと液面から蒸発して気体になっていき、最後は液体の水はなくなります。
5 〇 T2 は沸点で、100 ℃ です。
6 〇 100 ℃ で沸騰している状態なので、液体の水の体積は加熱とともに減少します。
第2問
問1 5
同温・同圧で比較するので、わかりやすく標準状態( 0 ℃、1.013 × 105 Pa)として考えます。
標準状態では、気体の種類によらず 22.4 L の体積の気体は、物質量が 1 mol です。
1 1.0 L のアルゴン Ar の物質量は、\(\frac{1.0[L]}{22.4[L/mol]}\) です。
物質量と気体の分子量(モル質量)の積が、求める質量です。
アルゴンの分子量は 40 です。
求める質量 = \(\frac{1.0}{22.4}\)[mol] × 40[g/mol] = \(\frac{40}{22.4}\)[g]
以下も同様に計算します。
2 二酸化炭素 CO2 の分子量は 44 なので
求める質量 = \(\frac{1.0}{22.4}\)[mol] × 44[g/mol] = \(\frac{44}{22.4}\)[g]
3 水素 H2 の分子量は 2.0 なので
求める質量 = \(\frac{3.0}{22.4}\)[mol] × 2.0[g/mol] = \(\frac{6.0}{22.4}\)[g]
4 メタン CH4 の分子量は 16 なので
求める質量 = \(\frac{3.0}{22.4}\)[mol] × 16[g/mol] = \(\frac{48}{22.4}\)[g]
5 アンモニア NH3 の分子量は 17 なので
求める質量 = \(\frac{3.0}{22.4}\)[mol] × 17[g/mol] = \(\frac{51}{22.4}\)[g]
分母の値は共通なので、分子の値を比べると 3.0 L のアンモニアが最も質量が大きいことがわかります。
問2 3
化学反応式の各原子について、両辺の数が等しくなるように係数を合わせます。
C2H4O2 の係数は 1 です。O2 の係数は a 、CO2 の係数は b 、H2O の係数は c です。
それぞれの原子について、左辺の数と右辺の数は等しくなります。
C原子の左辺と右辺の数: 2 × 1 + 0 × a = 1 × b + 0 × c
H原子: 4 × 1 + 0 × a = 0 × b + 2 × c
O原子: 2 × 1 + 2 × a = 2 × b + 1 × c
整理すると
C: 2 = b
H: 4 = 2c
O: 2 + 2a = 2b + c
この3式を解くと
b = 2
c = 2
a = 2
問3 5
密度 1.14 g/cm3 、質量パーセント濃度 32.0 % の塩酸 10.0 mL に含まれる塩化水素 HCl の物質量をまず計算します。
塩酸 10.0 mL ( = 10.0 cm3 ) の質量は、1.14[g/cm3] × 10.0[cm3] = 11.4[g]
その中に含まれる塩化水素の質量は、11.4[g] × \(\displaystyle\frac{32.0}{100}\)
塩化水素のモル質量(分子量)は 36.5 [g/mol] なので、
塩化水素の物質量は
$$11.4[g] × \frac{32.0}{100} × \frac{1}{36.5[g/mol]} ≒ 0.09994[mol]$$
この塩酸を 500mL に希釈しました。
このとき、500 mL の水溶液中に塩化水素は 0.09994 mol 溶解しています。
モル濃度は 1 L 当たりの物質量の濃度として計算されるので、求めるモル濃度は
0.09994[mol] × \(\displaystyle\frac{1000}{500}\)[/L] ≒ 0.200[mol/L]
希釈後の水溶液のモル濃度は、⑤の0.200 mol/L です。
問4 1
塩酸 HCl に水酸化ナトリウム NaOH 水溶液を滴下していくと、各イオンの濃度はどうなるのか考えます。
NaOH を加えていくと、Na+ イオンはそのまま水溶液に残り、OH- イオンは中和反応に使われます。
もともと存在した HCl の H+ イオンは中和反応に使われ、Cl- イオンはそのまま水溶液に残ります。
0.10 mol/L の塩酸( 1 価の酸)10 mL に、0.10 mol/L の水酸化ナトリウム( 1 価の塩基)を 10 mL 滴下したとき、はじめにあった H+ イオンがなくなって中和反応が終わります。
これらより、水酸化ナトリウム水溶液の滴下量が増えると、イオンのモル濃度が増え続ける a のグラフが Na+ イオンです。
水酸化ナトリウム水溶液の滴下量が増えるとイオンのモル濃度が減少し、滴下量が 10 mL となったときにモル濃度が 0 となる b のグラフは H+ イオンです。
水酸化ナトリウム水溶液の滴下量が 10 mL を超えると、イオンのモル濃度が 0 から増え始める c のグラフは OH- イオンです。
問5 7
直感的に、希釈後の水酸化ナトリウム水溶液の濃度は暗算できます。
0.020 mol/L の水酸化ナトリウム水溶液 50 mL を純水で希釈して 100 mL としたので、2 倍に希釈したことになります。
2 倍に希釈したので、モル濃度は 2 分の 1 の 0.010 mol/L となります。
直感でも求められますが、ここでは計算してみましょう。
0.020 mol/L の水酸化ナトリウム NaOH 水溶液 50 mL に含まれる NaOH の物質量は
0.020[mol/L] × \(\frac{50}{1000}\)[L] = 0.0010[mol]
この水溶液を希釈して 100 mL としているので、希釈後の NaOH 水溶液のモル濃度は
\(\frac{0.0010[mol]}{100[mL]}\) × 1000[mL/L] = 0.010[mol/L]
希釈後の NaOH 水溶液のモル濃度が求まりました。
NaOH 水溶液は 1 価の強塩基で、電離度は 1 と考えられます。
NaOH → Na+ + OH-
と電離します。
これより水酸化物イオン濃度 [OH-] = 0.010[mol/L] となるので、
水のイオン積 Kw = [H+] [OH-] = 1.0 × 10-14[mol2/L2] より
[H+] = 1.0 × 10-12[mol/L] となります。 [H+] = 10-pH と定義されるので、希釈後の水溶液の pH は 12 です。問6 4
1 SO2 全体の酸化数は 0 、O の酸化数は -2 なので、S 原子の酸化数は +4 です。
2 H2S 全体の酸化数は 0 、H の酸化数は +1 なので、S 原子の酸化数は -2 です。
3 NO2 全体の酸化数は 0 、O の酸化数は -2 なので、N 原子の酸化数は +4 です。
4 HNO3 全体の酸化数は 0 、H の酸化数は +1 、O の酸化数は -2 なので、N 原子の酸化数は +5 です。
5 N2 全体の酸化数は 0 なので、N 原子の酸化数は 0 です。(単体分子の原子の酸化数は 0 です。)
6 NH3 全体の酸化数は 0 、H の酸化数は +1 なので、N 原子の酸化数は -3 です。
問7 2
1 〇 イオン化傾向は銅 Cu より亜鉛 Zn の方が大きく、Zn は陽イオンになりやすいです。Zn が溶けて電子を放出し、Cu2+ イオンが電子を受け取り析出します。
2 × 塩化マグネシウム MgCl2 水溶液には、マグネシウムイオン Mg2+ と塩化物イオン Cl- が存在します。
イオン化傾向は鉄 Fe よりマグネシウム Mg の方が大きく、Mg は陽イオンになりやすいです。そのため Fe は溶けず、Mg2+ は陽イオンのままです。
3 〇 イオン化傾向は銀 Ag より銅 Cu の方が大きく、Cu は陽イオンになりやすいです。Cu は溶けて電子を放出し、Ag+ イオンが電子を受け取り析出します。
4 〇 亜鉛 Zn は塩酸に溶け、陽イオンとなります。放出された電子を塩酸の水素イオン H+ が受け取り、水素 H2 が発生します。
Zn + 2 HCl → ZnCl2 + H2
5 〇 白金 Pt は濃塩酸と濃硝酸の混合物である王水に溶けます。
