もくじ
第1問
問1 正解 6
単体は 1 種類の元素からできている純物質です。単体ではないということは、2 種類以上の元素からできている化合物や、複数の純物質からなる混合物が当てはまります。
1 黒鉛は C で表され、炭素元素が 1 種類だけでできているので、単体です。黒鉛は炭素原子の共有結合からなります。
2 単斜硫黄は S8 で表され、硫黄元素が 1 種類だけでできているので、単体です。単斜硫黄は硫黄原子の共有結合からなります。
3 水銀は金属で、Hg と表されます。水銀元素が 1 種類だけでできているので、単体です。
4 赤リンはリン元素が 1 種類だけでできているので、単体です。赤リンは P と表されます。
5 オゾンは酸素元素が 1 種類だけでできているので、単体です。オゾンは酸素原子からできている分子で、O3 と表されます。
6 水晶は二酸化ケイ素 SiO2 が成分の無機物質です。SiO2 はケイ素元素 Si と酸素元素 O の 2 種類から構成されるので、単体ではなく化合物です。
問2 正解 5
この問題を解くには、原子番号 20 のカルシウムまでの周期表の配置を覚えている必要があります。
また、原子がイオンになったときの電子の数の変化も、理解しておきましょう。
1 〇 ナトリウム Na は原子番号 11 の原子で、K 殻に 2 個、L 殻に 8 個、M 殻に 1 個の電子を持っています。
2 〇 マグネシウム Mg は原子番号 12 の原子で、K 殻に 2 個、L 殻に 8 個、M 殻に 2 個の電子を持っています。
3 〇 リチウム Li 原子は原子番号 3 の原子で、リチウムイオン Li+ になるとき 1 個の電子を失います。
リチウム原子からイオンが生成する式は次の通りです。
Li → Li+ + e-
リチウム原子では 3 個あった電子が 1 個失われ、リチウムイオンは 2 個の電子を持っています。
またヘリウム He 原子は原子番号 2 の原子なので、2 個の電子を持っています。
このように、リチウムイオンとヘリウム原子はともに 2 つの電子を持ち、同じ電子配置です。
4 〇 カルシウム Ca 原子は原子番号 20 の原子で、カルシウムイオン Ca2+ になるとき 2 個の電子を失います。
カルシウム原子からイオンが生成する式は次の通りです。
Ca → Ca2+ + 2 e-
カルシウム原子では 20 個あった電子が 2 個失われ、カルシウムイオンは 18 個の電子を持っています。
またアルゴン原子は原子番号 18 の原子なので、18 個の電子を持っています。
このように、カルシウムイオンとアルゴン原子はともに 18 個の電子を持ち、同じ電子配置です。
5 × フッ素は原子番号 9 の原子であり、K 殻に 2 個、L 殻に 7 個の電子を持っています。最外殻の電子数は 7 個なので、価電子は 7 個です。
なお、フッ素はハロゲン( 17 族元素)であり、フッ化物イオンとして 1 価の陰イオンになりやすい原子です。
6 〇 ケイ素は原子番号 14 の原子で、K 殻に 2 個、L 殻に 8 個、M 殻に 4 個という電子配置です。14 族元素であり最外殻の電子数は 4 個なので、価電子は 4 個です。
問3 正解 3
状態変化の用語です。
a :固体から気体になることを昇華といいます。逆方向の気体から固体になることも昇華といいます。
b :気体から液体になることを凝縮といいます。逆方向の液体から気体になることを蒸発といいます。
c :固体から液体になることを融解といいます。逆方向の液体から固体になることを凝固といいます。
問4 正解 2
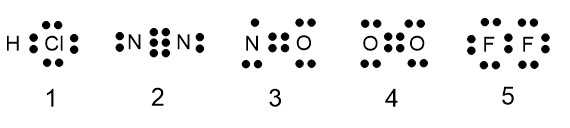
分子 XZ の電子式では、二つの原子の間で三重結合ができています。これは不対電子を 3 つもつ原子が結合しています。
①~⑤に含まれる原子で不対電子が 3 個あるのは、N だけです。
このように、三重結合をつくるのは窒素分子 N2 です。他の分子の電子式は以下の通りです。
問5 正解 1
無極性分子となるのは、すべて極性のない結合でできている分子か、または分子全体の形で結合の極性が打ち消されている分子です。
それぞれの分子の構造式を下に示します。
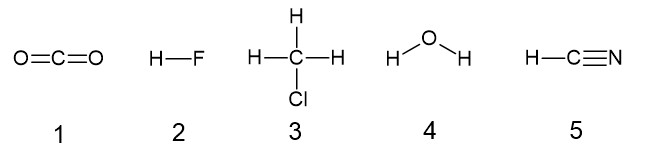
1 〇 C = O 結合に極性はありますが、分子が直線形なので極性は打ち消されます。
2 × HF の共有電子対はフッ素原子側に引き寄せられ、強い極性を持ちます。
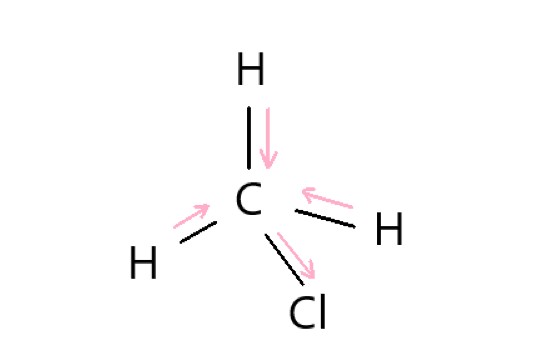
3 × C - H 結合には弱い極性、C - Cl 結合には強い極性があります。分子は正四面体形に近く、極性を打ち消さないので、分子全体でも極性があります。
4 × O - H 結合には強い極性があります。分子が折れ線形なので、極性が打ち消されず、分子全体で極性があります。
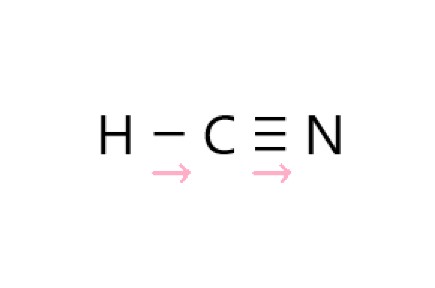
5 × H - C 結合の共有電子対は C 側に、C - N の三重結合では共有電子対は N 側に引き寄せられ、極性があります。
問6 正解 2
1 〇 塩素 Cl2 分子をつくっている Cl - Cl 結合は、完全な共有結合です。
2 × アンモニア NH3 分子をつくっている N - H 結合は、すべて共有結合です。
配位結合とは、一方の原子が他の原子に非共有電子対の電子を 2 個提供することによって、つくられる結合のことです。
ここでは、窒素原子と水素原子はそれぞれ 1 個ずつ電子を出して共有結合をつくっています。
3 〇 銅 Cu は金属であり、金属は金属結合で結晶をつくっています。
4 〇 塩化ナトリウム NaCl は、Na+ イオンと Cl- イオンの静電気的引力(クーロン力)でイオン結合をつくっています。
5 〇 炭酸カルシウム CaCO3 は、Ca2+ イオンと CO32- イオンがイオン結合をつくっています。
また炭酸イオン CO32- は、炭素原子と酸素原子が共有結合してイオンができています。
問7 正解 4
1 〇 プラスチックは主に石油を原料とする有機化合物であり、分子量の大きな高分子化合物です。
2 〇 白金は化学的に安定な金属です。
3 〇 非常に硬く融点の高いダイヤモンドは、共有結合でできた結晶です。
4 × 鉄は還元されて得られます。鉄鉱石は Fe2O3 のような酸化鉄が主成分です。
5 〇 アルミニウムは高温下での電気分解で得られますが、このとき大きな電力が必要です。
第2問
問1 正解 2
気体の種類によらず、0 ℃、1.013 × 105 Pa の条件下では、気体は物質量 1 mol で体積が 22.4 L です。
つまり同温・同圧(ここでは 0 ℃ ・ 1.013 × 105 Pa )の条件では、物質量が多いほど気体の体積は大きくなります。
気体の質量が 1 g であるとき、気体の分子量が小さいほど、その気体の物質量は大きくなります。
例えば、気体の分子量を M とすると、1 g の気体の物質量は
$$\frac{1}{M}mol$$
となります。
このとき、M が小さいほど気体の物質量は大きくなり、1 g の気体の体積は大きくなります。
それぞれの気体の分子量は、
① O2 = 16 × 2 = 32
② CH4 = 12 + 1.0 × 4 = 16
③ NO = 14 + 16 =30
④ H2S = 1.0 × 2 + 32 =34
であり、正解は②です。
問2 正解 1
プロパン C3H8 を完全燃焼させたときの化学反応式は次の通りです。
C3H8 + a O2 → b CO2 + c H2O
酸素と反応させて完全燃焼すると、二酸化炭素と水が生成します。
ここで、プロパン以外の化合物に係数をつけ、原子ごとに両辺の数を合わせると、反応式が完成します。
1 mol のプロパンを反応させているので、プロパンの係数は 1 です。
a mol の酸素が消費され、 b mol の二酸化炭素と c mol の水が生成したので、それぞれの係数を a と b と c で表します。
まず炭素原子を考えると、左辺は C3H8 に 3 個の炭素原子、右辺は CO2 に 1 個の炭素原子があります。
C: 3 × 1 = 1 × b
b = 3 とわかります。
C3H8 + a O2 → 3 CO2 + c H2O
次に水素原子を考えると、左辺は C3H8 に 8 個の水素原子、右辺は H2O に 2 個の水素原子があります。
H: 8 × 1 = 2 × c ‥‥(1)
最後に酸素原子を考えると、左辺は O2 に 2 個の水素原子、右辺は CO2 に 2 個の酸素原子と H2O に 1 個の水素原子があります。
O: 2 × a = 2 × 3 + 1 × c ‥‥(2)
(1)(2)式を解くと a = 5 、c = 4
正解は①となります。
問3 正解 3
1.0 L の水溶液中に、水酸化ナトリウム NaOH が 4.0 g 溶けています。
NaOH の分子量は 40 です。( 23 + 16 + 1.0 = 40 )
NaOH のモル質量は 40 g/mol なので、求めるモル濃度は
\(\displaystyle\frac{4.0[g/L]}{40[g/mol]}\) = 0.10[mol/L]
問4 正解 4
化学反応式で使われている ⇄ は、化学反応が左から右、あるいは右から左のどちらにも進むことを示しています。
( → のときは、化学反応が左から右だけに進み、反応物から生成物が生じます。)
本問では、下線を付けた分子およびイオンが反応物となって、生成物へと反応が進むときに酸としてはたらくかを確認します。
例えば下線 a の H2O では、反応が左から右の → で進むときに、H+ を与えるのか受け取るのかを確かめます。
下線 a の H2O は H+ を受け取り、下線 b の H3O+ となるので塩基だとわかります。
同様に下線 b の H3O+ では、反応が右から左の ← で進むときに、H+ を与えるのか受け取るのかを確かめます。
下線 b の H3O+ は H+ を与えて、下線 a の H2O となるので酸だとわかります。
反応Ⅰ
下線 a の H2O は、酢酸 CH3COOH から水素イオン H+ を受け取るので塩基です。
下線 b の H3O+ は、酢酸イオン CH3COO- に水素イオン H+ を与えるので酸です。
反応Ⅱ
下線 c の H2O はアンモニア NH3 に水素イオン H+ を与えるので酸です。
下線 d の OH- はアンモニウムイオン NH4+ から水素イオン H+ を受け取るので塩基です。
問5 正解 2
ア~ウは、酸と塩基の中和反応でできた塩です。
中和反応で生成する塩を水に溶かすと、その液性は塩によって決まります。
基本的には、強酸と強塩基から生じた塩を水に溶かすと中性、強酸と弱塩基から生じた塩を水に溶かすと酸性、弱酸と強塩基から生じた塩を水に溶かすと塩基性を示します。
本問では、この基本の考え方で解けます。
ア 酢酸ナトリウム CH3COONa は、弱酸の酢酸 CH3COOH と強塩基の水酸化ナトリウム NaOH からできた塩です。
この塩を水に溶かすと弱塩基であり、pH 7 より大きくなります。
イ 塩化アンモニウム NH4Cl は、強酸の塩化水素(塩酸) HCl と弱塩基のアンモニア NH3 からできた塩です。
この塩を水に溶かすと弱酸であり、pH 7 より小さくなります。
ウ 塩化ナトリウム NaCl は、強酸の塩化水素(塩酸) HCl と強塩基の水酸化ナトリウム NaOH からできた塩です。
この塩を水に溶かすと中性であり、pH 7 となります。
問6 正解 1
酸化数は、化合物内の水素原子が +1 、酸素原子が -2 となるのが基本です。アルカリ金属の原子は +1 、アルカリ土類金属( 2 族元素)は +2 とします。
また、化合物全体の酸化数はゼロです。そして、化合物を構成する各原子の酸化数の総和は、ゼロとなります。
これらのルールより、それぞれの原子の酸化数を求めます。
1 HNO3 の酸化数は 0 、H の酸化数は +1 、O の酸化数は -2 であるので、
(+1) + N + (-2) × 3 = 0
これを計算すると、HNO3 内の窒素原子の酸化数は N = +5
NO の酸化数は 0 、O の酸化数は -2 なので、
NO 内の窒素原子の酸化数は N = +2
したがって、窒素原子の酸化数は +5 から +2 へ 3 減少しています。
2 H2O2 = 0 、H = +1 であり O = -1
O2 = 0 より O = 0
酸素原子の酸化数は -1 から 0 へ 1 増加しています。
3 化合物内の水素原子の酸化数は +1 なので H = +1
H2 = 0 より H = 0
水素原子の酸化数は +1 から 0 へ 1 減少しています。
4 CaCO3 = 0 、Ca = +2 、O = -2 より C = +4
CO2 = 0 、O = -2 より C = +4
炭素原子の酸化数は +4 で変わりません。
問7 正解 3
図 1 のグラフからわかるように、金属 M が 4 g 反応すると、水素 H2 が 0.10 mol 発生しています。
また化学反応式を見ると、M が 1 mol 反応すると水素 H2 が 1 mol 生成しています。
ですから水素が 0.10 mol 発生しているときは、M も 0.10 mol 反応しています。
金属 M は質量 4 g で 0.10 mol であり、また原子量を X とすると質量 X g で 1 mol となります。
したがって、 4 g : 0.10 mol = X g : 1 mol となるので、
\(\frac{4[g]}{0.10[mol]}\) = X[g/mol]
X = 40
