もくじ
第1問
問1 正解 6
純物質はただひとつの物質から成る、純粋な物質です。純物質が複数混ざっている混合物を、選択肢から除きます。
1 × 石油には、重油・軽油・灯油・ガソリン・石油ガスなどの原料となるさまざまな有機化合物が含まれます。石油はこれらの混合物です。
2 × オリーブ油は、複数の植物油の成分が含まれる混合物です。オレイン酸やリノール酸、リノレン酸などが成分として含まれています。
3 × セメントは、酸化カルシウムや二酸化ケイ素、酸化アルミニウムなどを含む混合物です。
4 × 炭酸水は、水に二酸化炭素を溶かした液体です。水も二酸化炭素も純物質です。炭酸水は、水と二酸化炭素の混合物です。
5 × 空気の成分比は、約 78 %が窒素、約 21 %が酸素、1 %未満がアルゴン、二酸化炭素、ネオンなどとなっています。多くの純物質が含まれるので混合物です。
6 〇 ドライアイスは、二酸化炭素が固体の状態となっているものです。二酸化炭素だけでできているので、ドライアイスは純物質です。なお、ドライアイスは昇華性があります。
問2 正解 5
1 〇 枝付きフラスコから冷却器の方へ流れていく気体を、途中で冷やして液体にして、三角フラスコで集めます。このとき、三角フラスコに集める気体の温度を正確に測りたいです。
そのため、枝付きフラスコの枝の付け根あたりで、冷却器に流れ込む気体の温度を測る必要があります。
2 〇 枝付きフラスコに入れる液体の量は、フラスコの半分以下にします。これは液体が沸騰したときに、冷却器側に流れ込むのを防ぐためです。
3 〇 沸騰が急激に起こる突沸を防ぐため、実験を始める前に沸騰石を入れておきます。
4 〇 リービッヒ冷却器の冷却水の流れる向きは、下部から上部への方向です。
下部から流すことで冷却器内に水が溜まり、冷却効果が高くなります。さらに、流れてくる気体の向きと冷却水の向きが逆の方が、冷却効果が高まります。
5 × 得られた液体を集めるため、アダプターと三角フラスコをゴム栓で接続すると、実験装置内の圧力が高くなります。
加熱によって気体が発生し、フラスコやその他の実験器具内の圧力が高くなるので、フラスコが割れたりゴム栓が飛んだりといった危険性があります。
圧力を逃がすために、アダプターと三角フラスコは密閉せず、三角フラスコにはアルミ箔などをかぶせます。
問3 正解 1
1 × 周期表の縦の列は、族といいます。周期表の横の列が、周期です。
2 〇 金属の特徴は、金属光沢があって電気や熱を伝えやすく、薄く引き伸ばせることです。
金属元素の単体は、金属結晶をつくっています。金属結晶は自由電子をもち電子が動きやすいので、電気や熱をよく伝えます。
3 〇 アルカリ金属の原子は、水素を除く 1 族の元素です。アルカリ金属であるリチウムやナトリウム、カリウムなどの原子は、最外殻に電子を 1 個もちます。
4 〇 希ガスは反応性に乏しい、安定な元素です。
希ガスの原子は、最外殻電子数が 8 個です。ヘリウム原子は 2 個の電子をもち、外側の電子殻が埋まっています。そのため、希ガスは他の原子と結合しにくいです。
5 〇 3 族から 11 族までの元素は、遷移元素といいます。遷移元素はすべて金属元素です。1 族、2 族と 12 族から 18 族までの元素を、典型元素といいます。
問4 正解 2
ネオン Ne は原子番号が 10 で、最外殻の電子数が 8 個の希ガスです。電子配置は K 殻に 2 個、その外側の L 殻に 8 個となっています。
1 × ベリリウム Be は原子番号が 4 で、最外殻の電子数が 2 個です。Be2+ イオンは電子を 2 個失っているので、最外殻の電子を 2 個失い、残っている電子は 2 個です。
そのため原子番号が 2 のヘリウム He 原子と同じ電子配置となり、電子は K 殻の 2 個となります。
2 〇 マグネシウム Mg は原子番号が 12 で、電子は K 殻に 2 個、L 殻に 8 個、最外殻の M 殻に 2 個の電子が入っています。
Mg2+ イオンは電子を 2 個失っているので、最外殻の電子を 2 個失い、残っている電子は 10 個です。
そのため原子番号が 10 のネオン Ne 原子と同じ電子配置となり、電子は K 殻の 2 個、L 殻の 8 個となります。
3 × カリウム K は原子番号が 19 で、電子は K 殻に 2 個、L 殻に 8 個、M 殻に 8 個、最外殻の N 殻に 1 個の電子が入っています。
K+ イオンは電子を 1 個失っているので、最外殻の電子を 1 個失い、残っている電子は 18 個です。
そのため原子番号が 18 のアルゴン Ar 原子と同じ電子配置となり、電子配置は K 殻の 2 個、L 殻の 8 個、M 殻の 8 個となります。
4 × 塩素 Cl は原子番号が 17 で、電子は K 殻に 2 個、L 殻に 8 個、最外殻の M 殻に 7 個の電子が入っています。
Cl- イオンは電子を 1 個受け取っているので、最外殻の電子が 1 個増え、原子全体の電子は 18 個です。
そのため原子番号が 18 のアルゴン Ar 原子と同じ電子配置となり、電子配置は K 殻の 2 個、L殻の 8 個、M殻の 8 個となります。
5 × 硫黄 S は原子番号が 16 で、電子は K 殻に 2 個、L 殻に 8 個、最外殻の M 殻に 6 個の電子が入っています。
S2- イオンは電子を 2 個受け取っているので、最外殻の電子が 2 個増え、原子全体の電子は 18 個です。
そのため原子番号が 18 のアルゴン Ar 原子と同じ電子配置となり、電子配置は K 殻の 2 個、L 殻の 8 個、M 殻の 8 個となります。
問5 正解 3
共有結合の極性が大きくなるのは、それぞれの原子の電気陰性度の差が大きいときです。今回は片方が炭素原子で決まっていて、もう一方の原子が異なっています。
炭素原子と共有結合している 5 つの原子を見ると、窒素 N 、酸素 O 、フッ素 F 、塩素 Cl 、臭素 Br となっています。
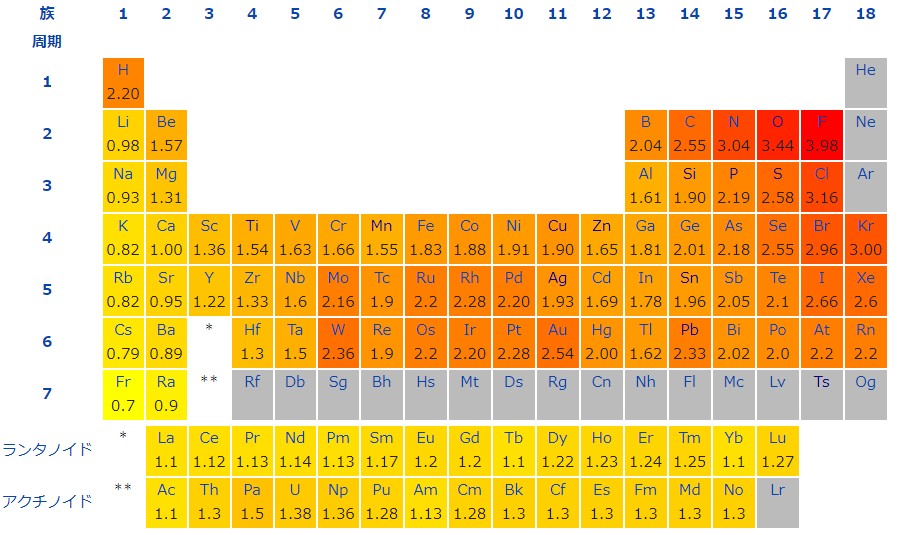
上の表は、各元素の電気陰性度の値です。
細かい値は覚える必要はありませんが、炭素のような重要な元素と、よく出る窒素 N 、酸素 O 、フッ素 F 、塩素 Cl 、臭素 Br などの元素とでは、どちらが電気陰性度が大きいかは知っておきましょう。
今回は、この 5 つの元素すべてが炭素より電気陰性度が大きいです。
そこで 5 つの元素のうちで、最も電気陰性度が大きい元素を選べば正解となります。
電気陰性度が大きい元素はハロゲンで、そのなかでも最大なのが原子番号の小さいフッ素 F です。選択肢に電気陰性度が最大の F があるので、これが正解です。
希ガスを除くと、周期表では一般に、右上にある元素が電気陰性度が大きくなります。
窒素 N 、酸素 O 、フッ素 F 、塩素 Cl 、臭素 Br で電気陰性度の大きい順に並べると、
F > O > Cl > N > Br
です。
問6 正解 3
1 〇 塩化水素 HCl は、水素原子 1 個と塩素原子 1 個が結合した分子です。H - Cl と結合しているので、直線形になります。

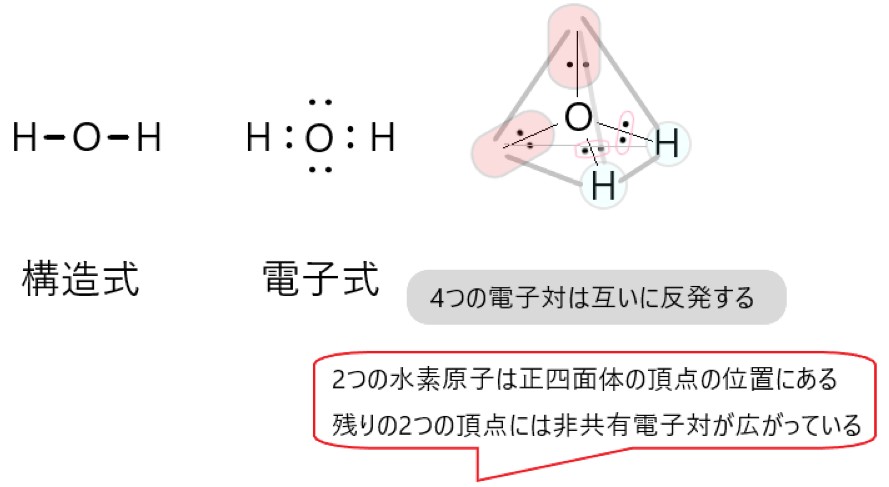
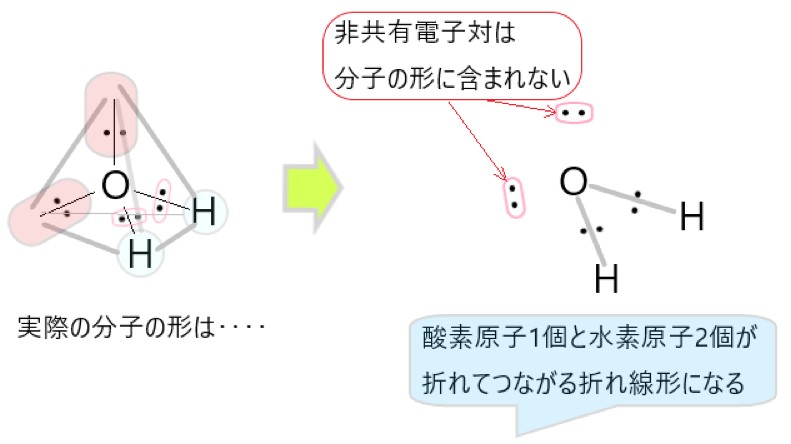
2 〇 水 H2O は、水素原子 2 個と酸素原子 1 個が結合した分子です。
H2O では、分子の中心を酸素原子と考えると、O-H 結合をつくっている共有電子対が 2 個、酸素原子につく非共有電子対が 2 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
しかし、非共有電子対は分子の形としては見えませんので、残るのは中心の酸素原子と、そこから正四面体の頂点方向にある水素原子 2 個です。そこで水分子の形は折れ線形に見えます。
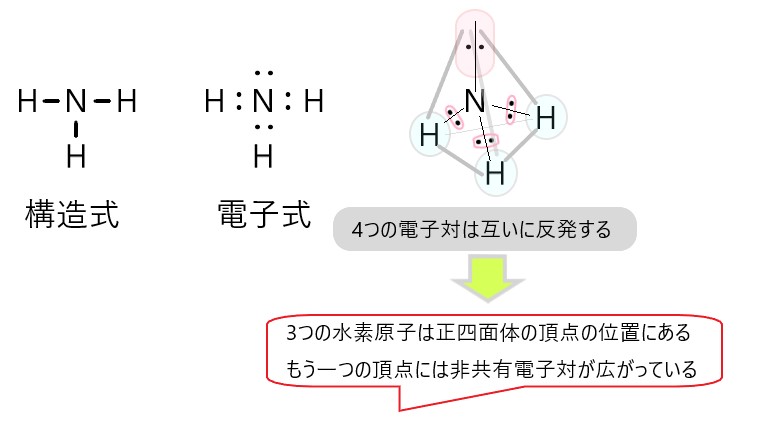
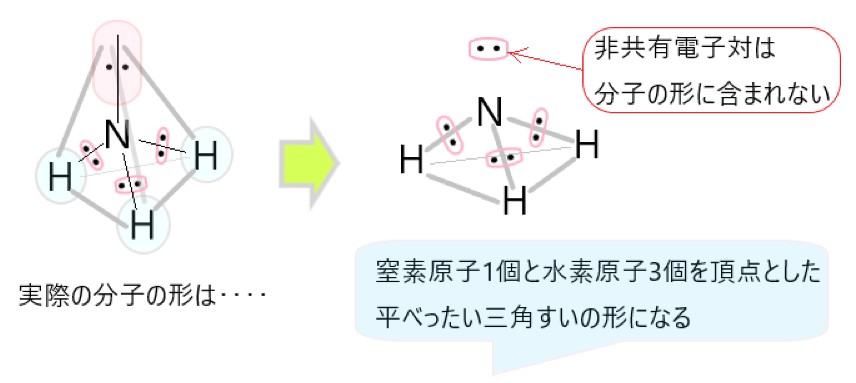
3 × アンモニア NH3 は、窒素原子 1 個と水素原子 3 個が結合した分子です。
NH3 では、分子の中心を窒素原子と考えると、N-H 結合をつくっている共有電子対が 3 個、窒素原子につく非共有電子対が 1 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
しかし、非共有電子対は分子の形としては見えませんので、残るのは中心の窒素原子と、そこから正四面体の頂点方向にある水素原子 3 個です。そこでアンモニアの形は三角錐形に見えます。
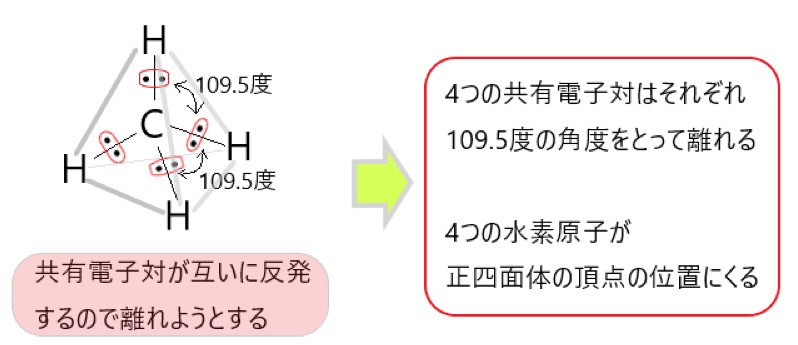
4 〇 メタン CH4 は、炭素原子 1 個と水素原子 4 個が結合した分子です。
CH4 では、分子の中心を炭素原子と考えると、C-H 結合をつくっている共有電子対が 4 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
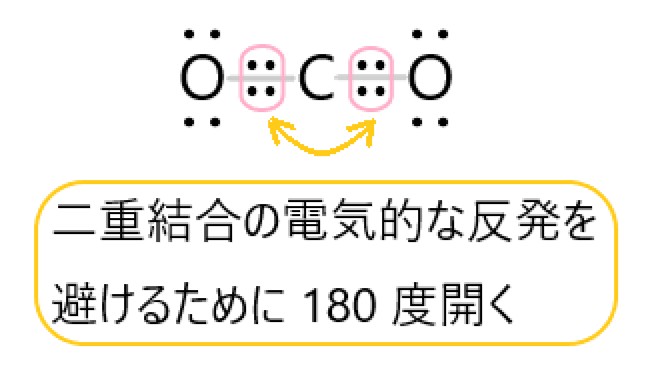
5 〇 二酸化炭素 CO2 は炭素原子 1 個と酸素原子 2 個が結合した分子です。
CO2 では、炭素原子と酸素原子は二重結合をつくります。
分子の中心を炭素原子と考えると、この二重結合が炭素原子を挟んで正反対の位置にあるので、分子全体では直線形になります。
炭素原子のまわりには二重結合の電子の塊が 2 つあるので、これらの反発が最も小さくなるのが直線形です。
問7 正解 1
1 × ステンレス鋼は、鉄とクロムやニッケルなどとの合金です。
2 〇 セッケンなどの洗剤は細長い分子構造をしており、水になじみやすい親水の部分と水になじみにくい疎水の部分があります。
油汚れは親水の部分に溶けにくく、疎水の部分に溶けやすいです。そのため、油汚れを疎水の部分が取り囲んで除き、洗剤が球状になって汚れを落とします。
3 〇 水道水には塩素 Cl2 が添加され、殺菌に使われています。
Cl2 は水中で強い酸化剤の次亜塩素酸 HClO となります。
Cl2 + H2O → HCl + HClO
この次亜塩素酸 HClO とイオン化した次亜塩素酸イオン ClO- は、病原微生物に対し殺菌作用があるので、細菌性赤痢やコレラなどを防ぐことができます。
4 〇 ビタミン C は、ビタミン C 自体が酸化されやすい還元剤です。そのためビタミン C を添加して、ビタミン C 自身が酸化されることで、食品の酸化を防止します。
5 〇 生石灰 CaO は吸湿性が強く、乾燥剤として使われます。
水との反応は以下の通りです。
CaO + H2O → Ca(OH)2
第2問
問1 正解 2
モル濃度が 0.1 mol/L の水溶液 1 L 中には、0.1 mol の溶質が含まれます。
そこで選択肢①~④の物質量 0.1 mol について、最も質量の小さいものを選びます。
これは 1 mol あたりの質量であるモル質量(分子量)で比べても、同じ結果になります。そこで①~④のモル質量を求めて、最もモル質量の値が小さい物質を選びます。
モル質量の値は、化合物中の各原子の原子量を足し合わせたものなので
1 NaCl のモル質量は 23 + 35.5 = 58.5 g/mol
2 NaOH のモル質量は 23 + 16 + 1.0 = 40 g/mol
3 MgCl2 のモル質量は 24 + 35.5 × 2 = 95 g/mol
4 CH3COOH のモル質量は 12 × 2 + 1.0 × 4 + 16 × 2 = 60 g/mol
となります。
これより、②が最も質量が小さくなります。
問2 正解 3
反応式より Na 2 mol が反応すると、H2 が 1 mol 生成することがわかります。
Na の原子量は 23 なので、Na のモル質量は 23 g/mol です。
グラフの横軸 0.23 g の位置は、Na の物質量が 0.01 mol にあたります。この Na 0.01 mol が反応したら、H2 は 0.005 mol 生成します。
横軸 0.23 g のところから垂直に上を見ていくと、発生した H2 の物質量が 0.005 mol となっている直線が正しい直線です。
直線③は Na が 0.23 g ( = 0.01 mol ) のとき、H2 が 0.005 mol 生成していることを示します。
問3 正解 6
質量パーセント濃度が 20 % の硝酸カリウム水溶液 1 L を考えます。
この溶液の密度は 1.1 g/cm3 なので、 1 L ( = 1000 cm3 ) あるときの質量は
1.1 g/cm3 × 1000 cm3 = 1100 g
となります。
水溶液全体の質量が 1100 g であり、質量パーセント濃度が 20 % なので、この水溶液の溶質の質量は
$$1100 × \frac{20}{100} = 220 g$$
です。
1 L の水溶液中に、硝酸カリウム KNO3 が 220 g 溶けていることがわかりました。
KNO3 のモル質量は、
39 + 14 + 16 × 3 = 101
101 g/mol となります。
したがって、質量が 220 g である KNO3 の物質量は
$$\frac{220 g }{101 g/mol} ≒ 2.2 mol$$
1 L の水溶液に 2.2 mol の溶質が溶けているので、モル濃度は 2.2 mol/L となります。
問4 正解 5
化合物中の酸素原子の酸化数は -2 です。また多原子イオン全体の酸化数は、イオン全体の電荷の値と等しいです。
多原子イオン全体の酸化数は、各原子の酸化数の総和となるので、これより下線で示した原子の酸化数をそれぞれ X として計算すると、
1 X + (-2) × 3 = -1
X = +5
窒素原子の酸化数は +5
2 X + (-2) × 3 = -2
X = +4
炭素原子の酸化数は +4
3 X + (-2) × 4 = -1
X = +7
マンガン原子の酸化数は +7
となります。
問5 正解 2
0.10 mol/L の塩酸 HCl は 1 価の強酸で、0.050 mol/L の NaOH 水溶液は 1 価の強塩基です。
中和の化学反応式は
HCl + NaOH → NaCl + H2O
となります。
1 価の強酸と 1 価の強塩基の中和滴定なので、中和点で pH は大きく酸性側から塩基性側へと変化します。
また、中和に必要な NaOH 水溶液の体積 X mL を計算します。
中和点で H+ と OH- の物質量が等しくなるので、
$$1 × 0.10 mol/L × \frac{10 mL}{1000 mL/L} = 1 × 0.050 mol/L × \frac{X mL}{1000 mL/L}$$
これを解くと X = 20 mL
NaOH 水溶液の滴下量が 20 mL のところで、大きく pH が酸性から塩基性に変化しているグラフ②が正解です。
問6 正解 4
1 〇 電池の正極では、電子が流れ込んで還元反応が起こります。
2 〇 電池の両極の電位差が、電池の起電力です。
3 〇 充電によって繰り返し使える電池を、二次電池または蓄電池といいます。
4 × 電池の負極では、電子を失う酸化反応が起こります。
亜鉛 Zn と銅 Cu を電極にするダニエル電池では、イオン化傾向が大きく、陽イオンになりやすい Zn が電子を失います。
そのため、電子を失い陽イオンとなる Zn が負極に使われます。
イオン化傾向が小さい Cu は正極に使われます。
5 〇 鉛蓄電池では、正極が酸化鉛(Ⅳ) PbO2 、負極が鉛 Pb となります。
放電で起こる化学反応は以下の通りです。
正極では、次のような電子を受け取る還元反応が起こります。
PbO2 + 4 H+ + SO42- + 2 e- → PbSO4 + 2 H2O
負極では、次のような電子を失う酸化反応が起こります。
Pb + SO42- → PbSO4 + 2 e-
問7 正解 1
1 × 水素よりイオン化傾向が小さい金属は、酸化力がない希硫酸に溶けません。Ag は水素よりイオン化傾向が小さいので、希硫酸と反応しません。
2 〇 カルシウム Ca は常温の水と反応して
Ca + 2 H2O → Ca(OH)2 + H2
となり、水素が発生します。
3 〇 亜鉛 Zn は水素よりイオン化傾向が大きいので、酸と反応します。
亜鉛 Zn は塩酸 HCl と反応して、
Zn + 2 HCl → ZnCl2 + H2
となり、水素を発生します。
4 〇 スズ Sn は水素よりイオン化傾向が大きいので、酸と反応します。
スズ Sn は希硫酸 H2SO4 と反応して、
Sn + H2SO4 → SnSO4 + H2
となり、水素を発生します。
5 〇 アルミニウム Al は高温の水蒸気と反応して、
2 Al + 3 H2O → Al2O3 + 3 H2
となり、水素が発生します。
