もくじ
実践問題
問1(2018試第1問問2)
生理食塩水は、塩化ナトリウムを水に溶かしたもので、ヒトの体液と塩分濃度がほぼ等しい水溶液であり、 10 mL の生理食塩水にはナトリウムイオンが 35 mg 含まれている。
生理食塩水に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 純粋な水と同じ温度で凍る。
② 硝酸銀水溶液を加えると、白色の沈殿を生じる。
③ ナトリウムイオンと塩化物イオンの数は等しい。
④ 黄色の炎色反応を示す。
(第2回 共通テスト試行調査 化学基礎 第1問問2 より一部を引用)
問2(2018試第1問問3)
図 1 のラベルが貼ってある 3 種類の飲料水 X ~ Z のいずれかが、コップⅠ~Ⅲにそれぞれ入っている。どのコップにどの飲料水が入っているかを見分けるために、BTB(ブロモチモールブルー)溶液と図 2 のような装置を用いて実験を行った。その結果を表 1 に示す。
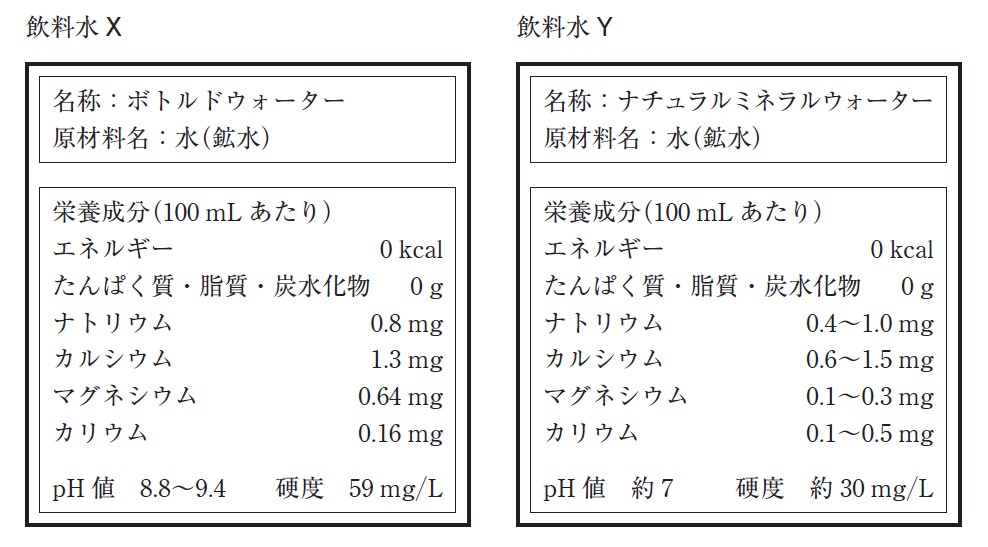

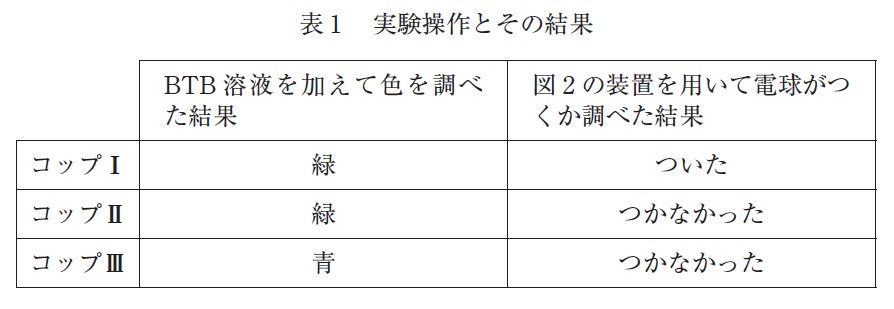
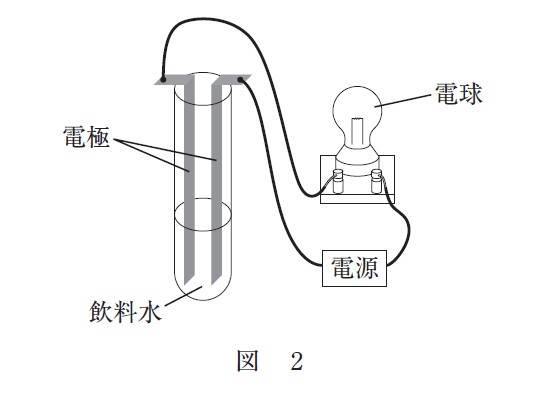
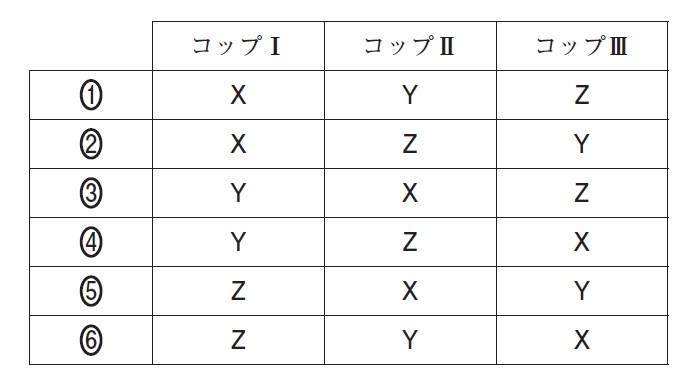
コップⅠ~Ⅲに入っている飲料水 X ~ Z の組合せとして最も適当なものを、次の①~⑥のうちから一つ選べ。ただし、飲料水 X ~ Z に含まれる陽イオンはラベルに示されている元素のイオンだけとみなすことができ、水素イオンや水酸化物イオンの量はこれらに比べて無視できるものとする。
(第2回 共通テスト試行調査 化学基礎 第1問問3 より引用)
問3(2018試第2問問1,2)
次の文章を読み、問い(問 Ⅰ ~ Ⅱ )に答えよ。
電気陰性度は、原子が共有電子対を引きつける相対的な強さを数値で表したものである。アメリカの化学者ポーリングの定義によると、表 1 の値となる。
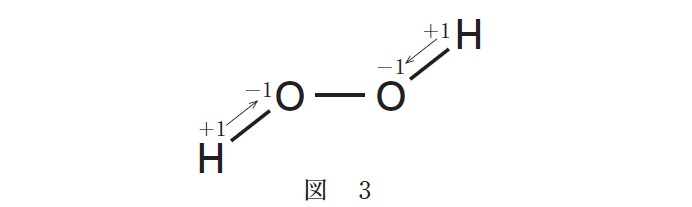
共有結合している原子の酸化数は、電気陰性度の大きい方の原子が共有電子対を完全に引きつけたと仮定して定められている。たとえば水分子では、図 1 のように酸素原子が矢印の方向に共有電子対を引きつけるので、酸素原子の酸化数は -2 、水素原子の酸化数は +1 となる。

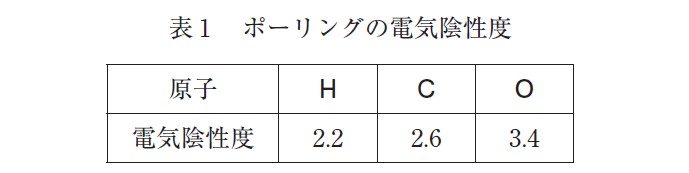
同様に考えると、二酸化炭素では、図 2 のようになり、炭素原子の酸化数は +4 、酸素原子の酸化数は -2 となる。
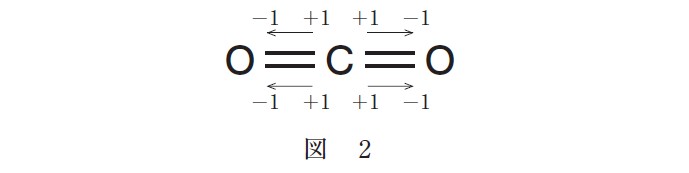
ところで、過酸化水素分子の酸素原子は、図 3 のように O-H 結合において共有電子対を引きつけるが、O-O 結合においては、どちらの酸素原子も共有電子対を引きつけることができない。したがって、酸素原子の酸化数はいずれも -1 となる。
問 Ⅰ
H2O 、H2 、CH4 の分子の形を図 4 に示す。これらの分子のうち、酸化数が +1 の原子を含む無極性分子はどれか。正しく選択しているものを、下の①~⑥のうちから一つ選べ。
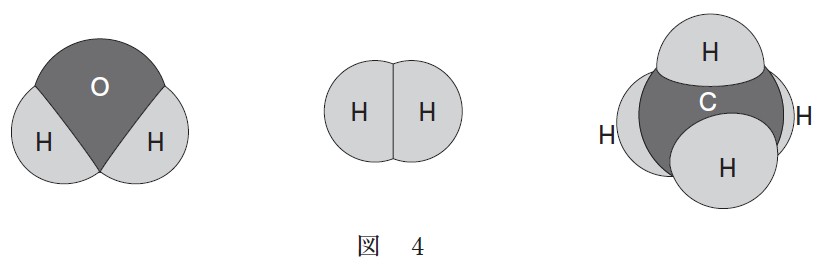
① H2O ② H2 ③ CH4 ④ H2O と H2
⑤ H2O と CH4 ⑥ H2 と CH4
(第2回 共通テスト試行調査 化学基礎 第2問問1 より引用)
問 Ⅱ
エタノールは酒類に含まれるアルコールであり、酸化反応により構造が変化して酢酸となる。
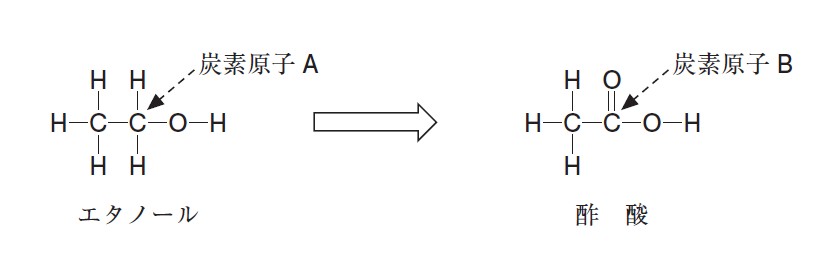
エタノール分子中の炭素原子 A の酸化数と、酢酸分子中の炭素原子 B の酸化数は、それぞれいくつか。最も適当なものを、次の①~⑨のうちから一つずつ選べ。ただし、同じものを繰り返し選んでもよい。
① +1 ② +2 ③ +3 ④ +4 ⑤ 0
⑥ -1 ⑦ -2 ⑧ -3 ⑨ -4
(第2回 共通テスト試行調査 化学基礎 第2問問2 より引用)
問4(2018試第3問問1~4)
学校の授業で、ある高校生がトイレ用洗浄剤に含まれる塩化水素の濃度を中和滴定により求めた。次に示したものは、その実験報告書の一部である。この報告書を読み、問い(問Ⅰ~Ⅳ)に答えよ。
「まぜるな危険 酸性タイプ」の洗浄剤に含まれる塩化水素濃度の測定
【目的】
トイレ用洗浄剤のラベルに「まぜるな危険 酸性タイプ」と表示があった。このトイレ用洗浄剤は塩化水素を約 10 %含むことがわかっている。この洗浄剤(以下「試料」という)を水酸化ナトリウム水溶液で中和滴定し、塩化水素の濃度を正確に求める。
【試料の希釈】
滴定に際して、試料の希釈が必要かを検討した。塩化水素の分子量は 36.5 なので、試料の密度を 1 g/cm3 と仮定すると、試料中の塩化水素のモル濃度は約 3 mol/L である。この濃度では、約 0.1 mol/L の水酸化ナトリウム水溶液を用いて中和滴定を行うには濃すぎるので、試料を希釈することとした。試料の希釈溶液 10 mL に、約 0.1 mol/L の水酸化ナトリウム水溶液を 15 mL 程度加えたときに中和点となるようにするには、試料を [ ア ] 倍に希釈するとよい。
【実験操作】
1. 試料 10.0 mL を、ホールピペットを用いてはかり取り、その質量を求めた。
2. 試料を、メスフラスコを用いて正確に [ ア ] 倍に希釈した。
3. この希釈溶液 10.0 mL を、ホールピペットを用いて正確にはかり取り、コニカルビーカーに入れ、フェノールフタレイン溶液を 2 、3 滴加えた。
4. ビュレットから 0.103 mol/L の水酸化ナトリウム水溶液を少しずつ滴下し、赤色が消えなくなった点を中和点とし、加えた水酸化ナトリウム水溶液の体積を求めた。
5. 3 と 4 の操作を、さらにあと 2 回繰り返した。
【結果】
1. 実験操作 1 で求めた試料 10.0 mL の質量は 10.40 g であった。
2. この実験で得られた滴下量は次のとおりであった。
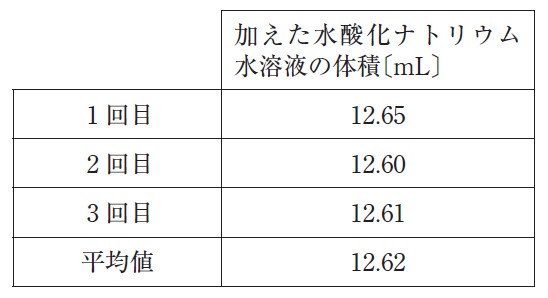
3. 加えた水酸化ナトリウム水溶液の体積を、平均値 12.62 mL とし、試料中の塩化水素の濃度を求めた。なお、試料中の酸は塩化水素のみからなるものと仮定した。
(中略)
希釈前の試料に含まれる塩化水素のモル濃度は、2.60 mol/L となった。
4. 試料の密度は、結果 1 より 1.04 g/cm3 となるので、試料中の塩化水素(分子量 36.5 )の質量パーセント濃度は [ イ ] %であることがわかった。
(以下略)
問Ⅰ
[ ア ] に当てはまる数値として最も適当なものを、次の①~⑤のうちから一つ選べ。① 2 倍 ② 5 倍 ③ 10 倍 ④ 20 倍 ⑤ 50 倍
問Ⅱ
別の生徒がこの実験を行ったところ、水酸化ナトリウム水溶液の滴下量が、正しい量より大きくなることがあった。どのような原因が考えられるか。最も適当なものを、次の①~④のうちから一つ選べ。
① 実験操作 3 で使用したホールピペットが水でぬれていた。
② 実験操作 3 で使用したコニカルビーカーが水でぬれていた。
③ 実験操作 3 でフェノールフタレイン溶液を多量に加えた。
④ 実験操作 4 で滴定開始前にビュレットの先端部分にあった空気が滴定の途中でぬけた。
問Ⅲ
[ イ ] に当てはまる数値として最も適当なものを、次の①~⑤のうちから一つ選べ。① 8.7 % ② 9.1 % ③ 9.5 % ④ 9.8 % ⑤ 10.3 %
問Ⅳ
この「酸性タイプ」の洗浄剤と、次亜塩素酸ナトリウム NaClO を含む「まぜるな危険 塩素系」の表示のある洗浄剤を混合してはいけない。これは、式(1)のように弱酸である次亜塩素酸 HClO が生成し、さらに式(2)のように次亜塩素酸が塩酸と反応して、有毒な塩素が発生するためである。
NaClO + HCl → NaCl + HClO (1)
HClO + HCl → Cl2 + H2O (2)
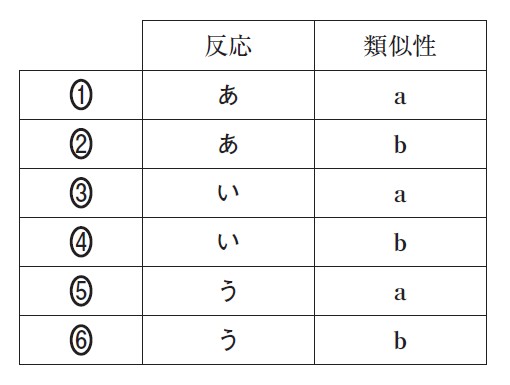
式(1)の反応と類似性が最も高い反応はあ~うのうちのどれか。また、その反応を選んだ根拠となる類似性は a 、b のどちらか。反応と類似性の組合せとして最も適当なものを、下の①~⑥のうちから一つ選べ。
【反応】
あ 過酸化水素水に酸化マンガン(Ⅳ)を加えると気体が発生した。
い 酢酸ナトリウムに希硫酸を加えると刺激臭がした。
う 亜鉛に希塩酸を加えると気体が発生した。
【類似性】
a 弱酸の塩と強酸の反応である。
b 酸化還元反応である。
(第2回 共通テスト試行調査 化学基礎 第3問問1~4 より引用)
