実践問題
問1(2019本第2問問5)
実験の安全に関する記述として適当でないものを、次の①~⑤のうちから一つ選べ。
① 薬品のにおいをかぐときは、手で気体をあおぎよせる。
② 硝酸が手に付着したときは、直ちに大量の水で洗い流す。
③ 濃塩酸は、換気のよい場所で扱う。
④ 濃硫酸を希釈するときは、ビーカーに入れた濃硫酸に純水を注ぐ。
⑤ 液体の入った試験管を加熱するときは、試験管の口を人のいない方に向ける。
(2019年度センター試験 本試験 化学基礎 第2問問5 より引用)
正解を見る
正解 4
1 〇 顔を近づけて薬品のにおいを鼻で直接かぐと、有毒な気体を大量に吸ってしまう可能性があるので危険です。一度に大量の薬品を吸い込まないように、手であおいでにおいをかぎます。
2 〇 薬品が皮膚についた場合は、すぐに大量の水で薬品を洗い流します。
3 〇 濃塩酸は毒性のある揮発性(蒸発しやすい)の液体なので、換気のよい場所で扱います。
4 × 濃硫酸を水で希釈するときは、大きな熱量が発生します。濃硫酸に水を垂らすと、水が沸騰して飛び散り危険です。ビーカーの純水に少しずつ濃硫酸を加えて希釈します。
5 〇 突沸(いきなり沸騰すること)などで薬品が飛び出る可能性があるので、試験管の口の方向には人がいないようにします。
問2(2020本第1問問4)
純物質の状態に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 液体では、沸点以下でも液面から蒸発がおこる。
② 気体から液体を経ることなく直接固体へ変化する物質は存在しない。
③ 気体では、一定温度であっても、空間を飛びまわる速さが速い分子や遅い分子がある。
④ 分子結晶では、分子の位置はほぼ固定されているが、分子は常温でも常に熱運動(振動)をしている。
(2020年度センター試験 本試験 化学基礎 第1問問4 より引用)
正解を見る
正解 2
1 〇 沸点以下の温度でも、液体は液面から蒸発してゆっくりと気体になっています。
2 × ヨウ素 I2 や二酸化炭素(ドライアイス) CO2 は、気体から固体に、また固体から気体に状態変化します。気体から固体、固体から気体への状態変化は昇華と言います。
3 〇 一定温度でも、気体分子の速度にはばらつきがあります。空間を速く飛びまわる分子も、ゆっくり動く分子もあります。
温度が高くなると気体分子の動きは活発になるので、気体分子の平均の速度は速くなります。
4 〇 分子は、気体・液体・固体のどの状態でも熱運動をしています。固体の分子結晶では分子の位置が決まっているので、分子はその位置で振動しています。
問3(2019本第1問問4)
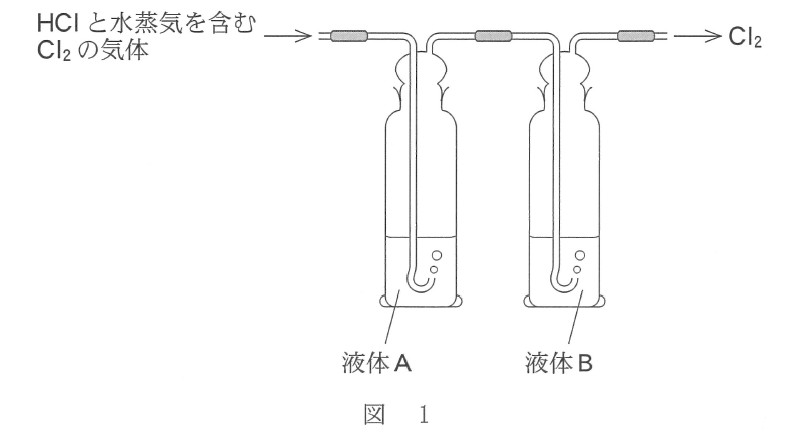
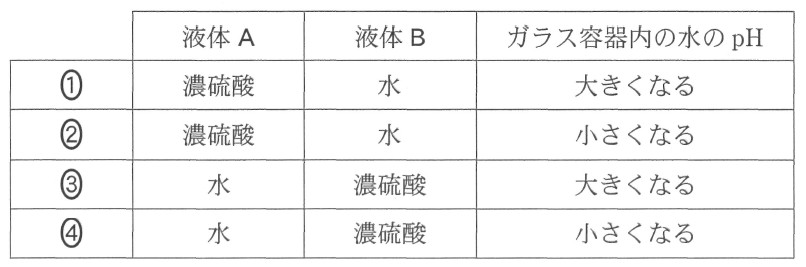
実験室で塩素 Cl2 を発生させたところ、得られた気体には、不純物として塩化水素 HCl と水蒸気が含まれていた。図 1 に示すように、二つのガラス容器(洗気びん)に濃硫酸および水を別々に入れ、順次この気体を通じることで不純物を取り除き、Cl2 のみを得た。これらのガラス容器に入れた液体 A と液体 B 、および気体を通じたことによるガラス容器内の水の pH の変化の組合せとして最も適当なものを、下の①~④のうちから一つ選べ。ただし、濃硫酸は気体から水蒸気を除くために用いた。
(2019年度センター試験 追試験 化学基礎 第1問問4 より引用)
正解を見る
正解 4
この操作では、2 つの洗気びんを通すことで、塩化水素 HCl と水 H2O を取り除きます。1 つの洗気びんで 1 つの物質(塩化水素か水のどちらか)を除きます。
まず、塩化水素 HCl を除くために気体を水に通します。塩化水素は水に溶けます。そのあとで濃硫酸に通して水蒸気を除きます。濃硫酸は水分を吸収します。
先に濃硫酸に通すと、次の水のガラス容器で再び水蒸気が発生してしまいます。
塩化水素を水に溶かすと塩酸になります。塩酸は強酸なので、洗気びんのなかの水は酸性になり pH は小さくなります。
問4(2019追第2問問1)
物質の量に関する記述として正しいものを、次の①~④のうちから一つ選べ。
① 窒素 28 g と酸素 28 g の物質量は、等しい。
② 水素 1.0 g の体積は、0 ℃、1.013 × 105 Pa において 22.4 L である。
③ 一酸化炭素と酸素の混合気体から二酸化炭素が生成すると、気体分子の総物質量は減少する。
④ 密閉ガラス容器内に鉄くぎと空気と少量の水を入れて放置すると、鉄くぎが酸化されて容器全体の質量が大きくなる。
必要があれば、原子量は次の値を使うこと。
H 1.0 N 14 O 16
(2019年度センター試験 追試験 化学基礎 第2問問1 より引用)
正解を見る
正解 3
1 × 窒素 28 g では、窒素原子の物質量は \(\frac{28[g]}{14[g/mol]}\) = 2.0[mol]となります。
酸素 28 g では、酸素原子の物質量は \(\frac{28[g]}{16[g/mol]}\) ≒ 1.8[mol]となります。
(窒素分子で考えると N2 なので、物質量は \(\frac{28[g]}{28[g/mol]}\) = 1.0[mol]
酸素分子で考えると O2 なので、物質量は \(\frac{28[g]}{32[g/mol]}\) ≒ 0.88[mol])
いずれにせよ物質量は等しくありません。
2 × 気体の水素分子は H2 なので、分子量は 2.0 です。
水素 1.0 g の物質量は \(\frac{1.0[g]}{2.0[g/mol]}\) = 0.50[mol] となります。
気体の性質として、0 ℃、1.013 × 105 Pa の条件下では、1 mol の気体の体積が 22.4 L です。
ここでは水素は 0.50 mol なので、体積は 11.2 L です。
3 〇 一酸化炭素と酸素が反応して二酸化炭素が生成する反応式は
2 CO + O2 → 2 CO2
つまり、2 mol の一酸化炭素と 1 mol の酸素が反応して、2 mol の二酸化炭素が生成しています。
はじめに 3 mol の混合気体があり、反応後に 2 mol の気体になったのですから、気体の総物質量は減少しています。
4 × 容器は密閉されていて、外部との物質の出入りはありません。内部で化学反応が起こったとしても、内部の物質(原子)そのものは増減しないので、容器全体の質量は一定です。
問5(2018本第1問問3)
電子の総数が N2 と同じものを、次の①~⑤のうちから一つ選べ。
① H2O ② CO ③ OH- ④ O2 ⑤ Mg2+
(2018年度センター試験 本試験 化学基礎 第1問問3 より引用)
正解を見る
正解 2
窒素原子が 7 個電子を持っているので、 N2 分子には電子は 14 個あります。
H2O 分子には 10 個 ( 1 × 2 + 8 ) の電子があります。
CO 分子には 14 個 ( 6 + 8 ) の電子があります。
OH- イオンには 10 個 ( 8 + 1 + 1 価の陰イオンなので 1 個の電子を受け取っています) の電子があります。
O2 分子には 16 個 ( 8 × 2 ) の電子があります。
Mg2+ イオンには 10 個 ( Mg は 12 個の電子を持つ原子ですが、これが 2 個の電子を失い 2 価の陽イオンになっています ) の電子があります。
問6(2018本第1問問6)
1.013 × 105 Pa のもとでの水の状態変化に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① ポリエチレン袋に少量の水を入れ、できるだけ空気を除いて密封し電子レンジで加熱し続けたところ、袋がふくらんだ。
② 氷水を入れたガラスコップを湿度が高く暖かい部屋に置いておいたところ、コップの外側に水滴がついた。
③ 氷を加熱し続けたところ、0 ℃で氷が融解しはじめ、すべての氷が水になるまで温度は一定に保たれた。
④ 水を加熱し続けたところ、100 ℃で沸騰しはじめた。
⑤ 水を冷却してすべてを氷にしたところ、その氷の体積はもとの水の体積よりも小さくなった。
(2018年度センター試験 本試験 化学基礎 第1問問6 より引用)
正解を見る
正解 5
1 〇 少量の水が加熱され水蒸気となり、体積が増え袋が膨らみます。
2 〇 コップの外側に接する気体は冷やされます。水は高い温度では多くの水蒸気が気体の状態で存在しますが、低い温度では少量の水蒸気しか存在しません。このため、湿度の高い空気が冷やされ、水蒸気が水となってコップの外側につきます。
3 〇 水の融点、凝固点は 0 ℃です。(固体から液体になる温度、液体から固体になる温度は 0 ℃です。)純物質である水が融解するときは、氷が融け始めてから完全に液体になるまで 0 ℃を保ちます。
4 〇 水の沸点は 100 ℃です。(沸騰して液体から気体になる温度は 100 ℃です。)
5 × 水を凍らせると、その氷は水より体積が大きくなります。氷が水に浮くのは、氷の密度が水より小さいからです。
問7(2017本第1問問6)
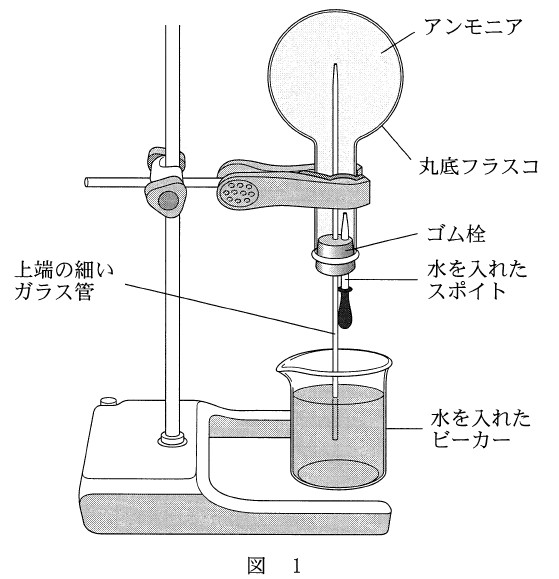
乾いた丸底フラスコにアンモニアを一定量捕集した後、図 1 のような装置を組み立てた。ゴム栓に固定したスポイト内の水を丸底フラスコの中に少量入れたところ、ビーカー内の水がガラス管を通って丸底フラスコ内に噴水のように噴き上がった。この実験に関する記述として誤りを含むものを、下の①~⑥のうちから一つ選べ。
① アンモニアを丸底フラスコに捕集するときには上方置換法を用いる。
② ゴム栓がゆるんですき間があると、水が噴き上がらないことがある。
③ 丸底フラスコ内のアンモニアの量が少ないと、噴き上がる水の量が少なくなる。
④ 内側が水でぬれた丸底フラスコを用いると、水が噴き上がらないことがある。
⑤ ビーカーの水に BTB(ブロモチモールブルー)溶液を加えておくと、噴き上がった水は青くなる。
⑥ アンモニアの代わりにメタンを用いても、水が噴き上がる。
(2017年度センター試験 本試験 化学基礎 第1問問6 より引用)
正解を見る
正解 6
実験で起きた現象は、次のように考えられます。
乾いたフラスコ内にアンモニアが充満しているところに、スポイトから水を少量入れました。
アンモニアは非常に水に溶けやすいので、スポイトから入れた水にアンモニア気体の一部が溶け、フラスコ内の圧力が下がってビーカーの水を吸い上げました。
1 〇 アンモニア NH3 の分子量は 17 で、平均分子量が約 28.8 の空気より軽いです。また空気より軽いアンモニアは水に溶けやすいので、上方置換法で捕集します。
2 〇 ゴム栓の隙間から空気が入ると、フラスコ内の圧力が下がらず、水を吸い上げない可能性があります。
3 〇 アンモニアの量が少ないと、フラスコ内の圧力の下がり方が小さく、あまり水を吸い上げません。
4 〇 フラスコ内が水でぬれていると、はじめからアンモニアがフラスコ内の水滴に溶けて、アンモニアが減ってしまいます。
5 〇 フラスコ内に噴き上がった水にアンモニアが溶けると、水は塩基性になります。ブロモチモールブルー溶液は塩基性で青くなるので、水は青くなります。
6 × メタンは水にほとんど溶けないので、スポイトで水を入れてもフラスコ内の圧力は変わらず、水を吸い上げません。
問8(2017追第2問問4)
目的とする濃度の水溶液を調製する方法として正しいものを、次の①~④のうちから一つ選べ。
① 0.100 mol/L のシュウ酸水溶液をつくるために、12.6 g のシュウ酸二水和物 (COOH)2・2 H2O を水に溶かして 1.00 L とした。
② 0.100 mol/L の塩酸をつくるために、1.00 mol/L の塩酸 10.0 g をとり、水 990 g に加えた。
③ pH 2.0 の硫酸水溶液をつくるために、0.100 mol/L の硫酸 10.0 mL に水を加えて 100 mL とした。
④ 質量パーセント濃度 10.0 % の水酸化ナトリウム水溶液をつくるために、100 g の水酸化ナトリウムを水に溶かして 1.00 L とした。
必要があれば、原子量は次の値を使うこと。
H 1.0 C 12 O 16
(2017年度センター試験 追試験 化学基礎 第2問問4 より引用)
正解を見る
正解 1
1 〇 シュウ酸二水和物 (COOH)2・2 H2O のモル質量は、(12 + 16 × 2 + 1.0) × 2 + (1.0 × 2 + 16) = 126[g/mol]
12.6 g のシュウ酸二水和物の物質量は
\(\frac{12.6[g]}{126[g/mol]}\) = 0.100[mol]
これを水に溶かして 1.00 L の水溶液にしているので、シュウ酸のモル濃度は 0.100 mol/L となります。
2 × 1.00 mol/L の塩酸の密度は 1.00 g/cm3 ではないので、塩酸 10.0 g をとってもその体積がわからず、含まれる HCl の物質量が計算できません。
これに水 990 g を加えても塩化水素 HCl の物質量は不明なので、塩酸のモル濃度もわかりません。
3 × 水を加えたあとの硫酸は 10 倍に希釈されているので、モル濃度が\(\frac{1}{10}\)となり 0.0100 mol/L となります。
硫酸は 2 価の強酸なので、水素イオン濃度は 0.02 mol/L に近くなります。
[H
+] = 0.02[mol/L] の水溶液は pH 2 より小さいので、この溶液も pH 2 よりは小さいです。
4 × 質量パーセント濃度を 10.0 % にするためには、100 g の水酸化ナトリウムを水に溶かして 1000 g の水溶液にしなければなりません。
そのため、900 g の水を加えます。
問9(2016本第1問問1)
同位体に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① 互いに同位体である原子は、質量数が異なる。
② 互いに同位体である原子は、電子数が異なる。
③ 互いに同位体である原子は、同じ元素記号で表される。
④ 原子量は、同位体の相対質量を、存在比を用いて平均した値である。
⑤ 地球上の物質中には、放射性同位体を含むものがある。
(2016年度センター試験 本試験 化学基礎 第1問問1 より引用)
正解を見る
正解 2
1 〇 同じ元素でも同位体はそれぞれ中性子の数が異なるので、質量数も違います。
2 × 同位体は原子番号が同じ(つまり陽子の数が同じ)で、中性子の数が異なる原子同士のことをいいます。陽子の数が同じなので、電子の数も同じです。
3 〇 同位体は同じ元素のうち、中性子の数が異なる原子のことを指します。
4 〇 原子量は、その元素のすべての同位体を集めたときの平均の質量です。
例えば塩素原子 Cl は、質量数 35(相対質量 34.97) の存在比が約 76 %、質量数 37(相対質量 36.97)の存在比が約 24 %なので、
原子量 = 34.97 × 約0.76 + 36.97 × 約0.24 ≒ 35.45
となります。周期表で確かめても、Cl の原子量は35.452と書かれています。
5 〇 ある元素の同位体が不安定であるために、原子核が崩壊しながら放射線を放出するものを放射性同位体といいます。
質量数 3 の水素原子や、質量数 14 の炭素原子が放射性同位体です。
問10(2016本第1問問2)
次の記述( a ・ b )に当てはまる分子またはイオンとして最も適当なものを、下の①~⑥のうちから一つずつ選べ。ただし、同じものを選んでもよい。
a 非共有電子対が存在しない
b 共有電子対が 2 組だけ存在する
① H2O ② OH- ③ NH3
④ NH4+ ⑤ HCl ⑥ Cl2
(2016年度センター試験 本試験 化学基礎 第1問問2 より引用)
正解を見る
正解 a 4 b 1
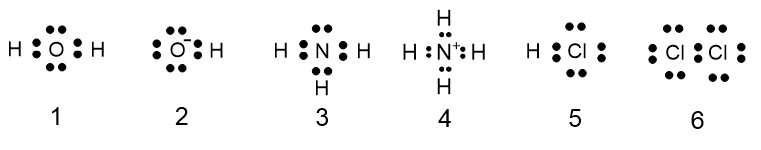
上図は①から⑥の電子式です。
図の通り、
① 共有電子対 2 個と非共有電子対 2 個
② 共有電子対 1 個と非共有電子対 3 個
③ 共有電子対 3 個と非共有電子対 1 個
④ 共有電子対 4 個と非共有電子対 0 個
⑤ 共有電子対 1 個と非共有電子対 3 個
⑥ 共有電子対 1 個と非共有電子対 6 個
となります。
問11(2016追第1問問2)
原子に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① 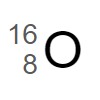 では陽子の数と中性子の数が等しい。
では陽子の数と中性子の数が等しい。
② 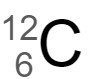 と
と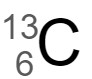 は同じ元素なので、ほとんど同じ化学的性質を示す。
は同じ元素なので、ほとんど同じ化学的性質を示す。
③ 第 2 周期と第 3 周期の同族元素間の陽子数の差は 8 である。
④ 原子の質量は、原子番号に比例する。
⑤ 多くの元素には、同位体が存在する。
(2016年度センター試験 追試験 化学基礎 第1問問2 より引用)
正解を見る
正解 4
1 〇
この酸素原子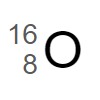 は原子番号 8(陽子の数 8 )で、質量数が 16 です。
は原子番号 8(陽子の数 8 )で、質量数が 16 です。
質量数 = 陽子の数 + 中性子の数
ですから、中性子の数は 8 です。
2 〇
この2つの炭素原子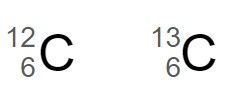 は、中性子の数が 1 異なる同位体です。
は、中性子の数が 1 異なる同位体です。
左の炭素原子は質量数 12 で原子番号 6 なので、陽子の数と電子の数は 6 個、中性子の数は 6 個です。
右の炭素原子は質量数 13 で原子番号 6 なので、陽子の数と電子の数は 6 個、中性子の数は 7 個です。
中性子の数だけが異なる原子同士は、同位体と呼ばれます。同位体の化学的性質はほとんど同じです。
3 〇 第 2 周期と第 3 周期の同族元素では、原子番号が 8 ずれています。原子番号に 8 だけ差があるので、陽子の数の差も 8 です。
4 × それぞれの原子の質量は、相対質量として表されます。この相対質量は、質量数とほぼ一致します。
そのため、原子の質量は質量数にほぼ比例します。
一方、質量数 = 陽子の数 + 中性子の数
となるので、原子の質量は原子番号(陽子の数)に比例しません。
5 〇 記述のとおり、多くの元素は同位体をもちます。
問12(2016追第1問問3)
常温・常圧での単体に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① オゾンは酸素の同素体である。
② ナトリウムの単体は電気を通す。
③ 硫黄の単体には、斜方硫黄、単斜硫黄、ゴム状硫黄がある。
④ 水銀の単体は液体である。
⑤ 塩素の単体は、原子 1 個からなる分子である。
(2016年度センター試験 追試験 化学基礎 第1問問3 より引用)
正解を見る
正解 5
1 〇 オゾン O3 と酸素 O2 は酸素元素の同素体です。
2 〇 ナトリウムは金属です。金属の単体は金属結晶で、結晶内を自由に電子が動けるので電気を通します。
3 〇 硫黄元素の同素体には、斜方硫黄、単斜硫黄、ゴム状硫黄があります。
斜方硫黄と単斜硫黄は黄色の S8 で表される環状分子、ゴム状硫黄は黄~黄褐色の鎖状分子です。
4 〇 水銀の単体は水銀の金属結晶です。水銀は常温常圧で液体の状態となる、ただひとつの金属です。
5 × 塩素の単体は、二原子分子の塩素 Cl2 です。2 つの原子が共有結合しています。
問13(2020追第1問問3)
第 3 周期までの典型元素に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 同じ周期の元素では、原子番号の増加とともに、最外殻の電子の数が増加する。
② すべての 18 族元素では、価電子の数が 0 である。
③ 第 2 周期と第 3 周期の同族の元素間では、原子がもつ陽子の総数の差は 8 である。
④ 同族の元素では、原子番号の大きい原子ほどイオン化エネルギーが大きい。
(2020年度センター試験 追試験 化学基礎 第1問問3 より引用)
正解を見る
正解 4
1 〇 同じ周期の元素では、原子番号が 1 大きくなると、最外殻電子数は 1 増えます。
2 〇 He は最外殻の電子数が 2 個、Ne と Ar は最外殻の電子数が 8 個で、価電子は 0 個となります。
3 〇 第 2 周期と第 3 周期の同族の元素では原子番号が 8 ずれているので、陽子数の差は 8 個です。
4 × イオン化エネルギーは、電子 1 個を取り去るために必要なエネルギーです。イオン化エネルギーは、周期表の左下の元素が小さい傾向です。
原子核(陽子)から遠い位置にある電子の方が、近い位置にある電子より離れやすいので、同族元素では原子番号が大きいとイオン化エネルギーは小さくなります。
問14(2020追第1問問7)
6 種類の純物質、塩化カリウム、炭酸水素ナトリウム、炭酸カルシウム、硫酸バリウム、鉄、銅の粉末がある。そのうち 2 種類の純物質アと純物質イの混合物に対して、図 1 のような分離操作を行った。
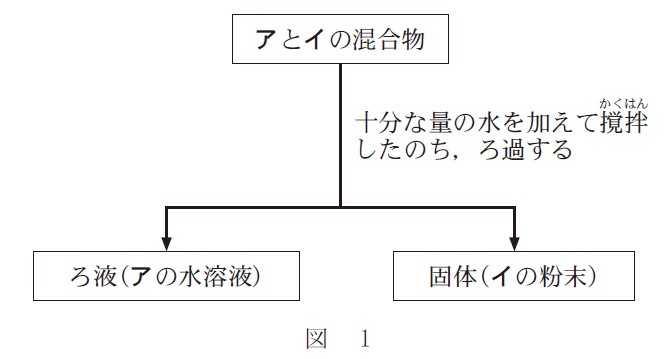
この操作で得られたろ液および固体について、次の実験Ⅰ・Ⅱを行った。
実験Ⅰ ろ液を白金線の先につけてガスバーナーの外炎に入れたところ、炎の色が赤紫色になった。
実験Ⅱ 固体に塩酸を注いだところ、気体が発生した。この気体は、無色無臭で空気より軽く、水に不溶で、可燃性であった。
ろ液に含まれるアと固体のイに当てはまるものとして最も適当なものを、次の①~⑥のうちから一つずつ選べ。
① 塩化カリウム ② 炭酸水素ナトリウム ③ 炭酸カルシウム
④ 硫酸バリウム ⑤ 鉄 ⑥ 銅
(2020年度センター試験 追試験 化学基礎 第1問問7 より引用)
正解を見る
正解 ア 1 イ 5
6 種類の純物質のうち、水に溶けてろ液に含まれるのは 2 種類です。
塩化カリウム KCl 、炭酸水素ナトリウム NaHCO3 が溶けます。
他の炭酸カルシウム CaCO3 、硫酸バリウム BaSO4 、鉄 Fe 、銅 Cu は水に溶けずに固体のままです。
実験Ⅰでは金属の炎色反応を調べています。
カリウムイオンは赤紫色、ナトリウムイオンは黄色です。炎の色が赤紫色なので、アは塩化カリウムと考えられます。
実験Ⅱについて、塩化カリウム以外の 5 種類の純物質との反応を考えます。
(a) 炭酸水素ナトリウム NaHCO3 に塩酸を加えると、二酸化炭素が発生します。
NaHCO3 + HCl → NaCl + H2O + CO2
二酸化炭素は空気より重く、水に少し溶け、燃焼しません。
(b) 炭酸カルシウム CaCO3 に塩酸を加えると、二酸化炭素が発生します。
CaCO3 + 2 HCl → CaCl2 + H2O + CO2
(c) 硫酸バリウム BaSO4 に塩酸を加えても反応しません。
(d) 鉄 Fe に塩酸を加えると、水素が発生します。
Fe + 2 HCl → FeCl2 + H2
水素は無色無臭で空気より軽く、水にほとんど溶けず、爆発的に燃焼します。したがってイは鉄です。
(e) 銅 Cu に塩酸を加えても反応しません。硝酸など酸化力のある酸に溶けます。



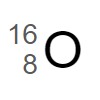 では陽子の数と中性子の数が等しい。
では陽子の数と中性子の数が等しい。![]() と
と![]() は同じ元素なので、ほとんど同じ化学的性質を示す。
は同じ元素なので、ほとんど同じ化学的性質を示す。


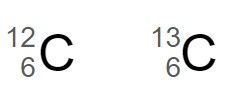 は、中性子の数が 1 異なる同位体です。
は、中性子の数が 1 異なる同位体です。