もくじ
第1問
問1 正解 3
この問題は、元素が A である原子 A の例です。元素記号 A の左上と左下に数字が書かれています。
左下の数字は原子番号で、左上の数字は質量数です。
原子番号は、その原子がもつ陽子の数と一致します。また質量数は、その原子の陽子の数と中性子の数の和です。
したがって原子 A は、原子番号 9(つまり陽子数が 9 個)の原子です。
原子がもつ陽子の数と電子の数は等しいので、原子 A がもつ電子の数も 9 個です。
質量数は 19 なので、中性子の数は
質量数 = 陽子の数 + 中性子の数
ですから
19 = 9 + 中性子の数
となり、中性子の数は 10 個です。
1 〇 電子が 9 個ある原子では、まず一番内側の殻( K 殻)に 2 個の電子が入ります。そのあと、7 個の電子がその外側の L 殻に入ります。したがって、最外殻の電子数は 7 個です。
2 〇 原子番号が 9 なので、陽子の数は 9 個です。
3 × 質量数は陽子の数と中性子の数の和です。中性子の数は正しくは 10 個です。
4 〇 元素記号の左上に書かれた数字は、質量数です。
問2 正解 ア 4 イ 2
ア 固体から気体への状態変化、または気体から固体への状態変化を昇華といいます。
多くの物質は、固体を加熱すると液体になり、さらに高温になると気体になります。しかし一部の物質は、固体を加熱すると直接気体になる変化(昇華)をします。
これを利用して分離する方法を、昇華法といいます。
したがって、アの選択肢は ④ です。
よく出る例として、固体の不純物と固体のヨウ素が混合しているとき、ヨウ素のみを分離する操作があります。
砂とヨウ素が混ざっているとき、この混合物を加熱すると、砂は固体のままですが、ヨウ素の一部は昇華して気体になります。
このヨウ素の気体を逃がさずに冷やすと、ヨウ素が冷えて固体に戻ります。この固体のヨウ素を回収すると、不純物のないヨウ素のみを分離することができます。
イ 液体の物質と固体の物質の組合せでは、溶けやすいものと溶けにくいものがあります。
例えば、油っぽい固体の物質は水には溶けにくいが油には溶けやすい性質があります。逆に水に溶けやすい固体は、油に溶けないことがあります。
これをもう少し正確に言えば、以下のようになります。
極性のある水と極性のない有機溶媒を混ぜると、極性のある物質は水溶液側に、極性のない有機化合物は有機溶媒側に溶けて分離します。
このようにして目的の物質を分離する方法を抽出といいます。
したがって、イの選択肢は ② です。
生活の中で見られる抽出の例では、お茶やコーヒーがあります。
茶葉やコーヒー豆を、お湯と混ぜ合わせます。この抽出の操作で、お茶やコーヒーの香りや味の成分が、お湯に溶け出してお湯のなかに移動します。
茶葉やコーヒー豆から、香りや味の成分という目的の物質を溶かし出して分離しているので、これは抽出です。
問3 正解 5
NiO の式量は 75 です。そこで、1.5 g 中の NiO には Ni が
1.5[g] × \(\frac{59}{75}\) = 1.18[g]
含まれます。
はじめの合金は 6.0 g ですので、Ni の含有量は
\(\frac{1.18[g]}{6.0[g]}\) × 100 ≒ 20%
となります。
(別解)
1.5 g の NiO は \(\frac{1.5[g]}{75[g/mol]}\) = 0.020[mol] です。
NiO 1 mol には Ni が 1 mol 含まれているので、もとの合金には 0.020 mol の Ni がありました。
もとの合金にあった Ni は、59[g/mol] × 0.020[mol] = 1.18[g] です。
求める含有率は \(\frac{1.18[g]}{6.0[g]}\) × 100 ≒ 20%
問4 正解 4
この操作では、2 つの洗気びんを通すことで、塩化水素 HCl と水 H2O を取り除きます。1 つの洗気びんで 1 つの物質(塩化水素か水のどちらか)を除きます。
まず、塩化水素 HCl を除くために気体を水に通します。塩化水素は水に溶けます。そのあとで濃硫酸に通して水蒸気を除きます。濃硫酸は水分を吸収します。
先に濃硫酸に通すと、次の水のガラス容器で再び水蒸気が発生してしまいます。
塩化水素を水に溶かすと塩酸になります。塩酸は強酸なので、洗気びんのなかの水は酸性になり pH は小さくなります。
問5 正解 1
1 × イオン化エネルギーは、最外殻の電子を取り去って陽イオンになるために必要なエネルギーです。
イオン化エネルギーが小さいほうが、電子が容易に放出されて陽イオンになりやすいです。
したがって、イオン化エネルギーが大きい原子では、電子を放出するのに大きなエネルギーが必要です。原子が電子を失いにくいので、陽イオンにはなりにくいです。
2 〇 電気陰性度は共有結合の電子対を引き付ける強さです。周期表では、電気陰性度は右上にいくにつれ大きくなる傾向( 18 族元素は除く)です。
したがって第 2 周期の元素でも、希(貴)ガスを除けば、周期表の右側にいくほど電気陰性度は大きくなります。
3 〇 ハロゲンの原子は最外殻の電子数が 7 個であり、1 個の電子を受け取り 1 価の陰イオンとなりやすいです。
4 〇 遷移元素は最外殻の電子数がどれも 1 個か 2 個のため、隣り合う元素と似た性質を持ちやすいです。
問6 正解 3
アンモニア分子 NH3 、アンモニウムイオン NH4+ 、オキソニウムイオン H3O+ 、二酸化炭素分子 CO2 それぞれの電子式は以下の通りです。
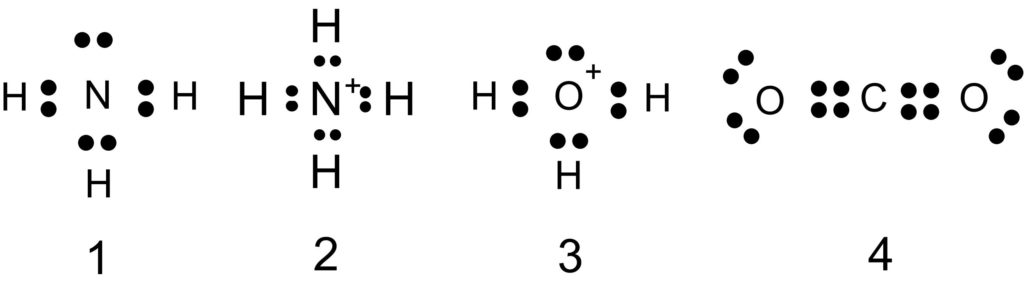
1 〇 アンモニア分子には、3 組の共有電子対と 1 組の非共有電子対があります。
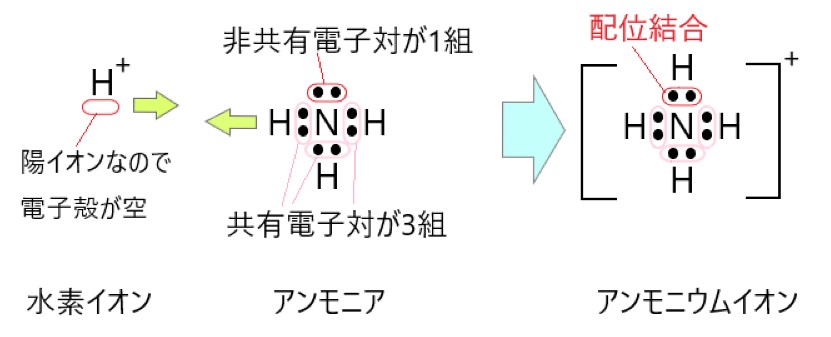
2 〇 アンモニウムイオンには、4 組の共有電子対があります。
この 4 組の共有電子対は、もともとは 3 組の共有電子対と 1 組の配位結合でした。共有電子対と配位結合は区別できないので、共有電子対が 4 組あることになります。
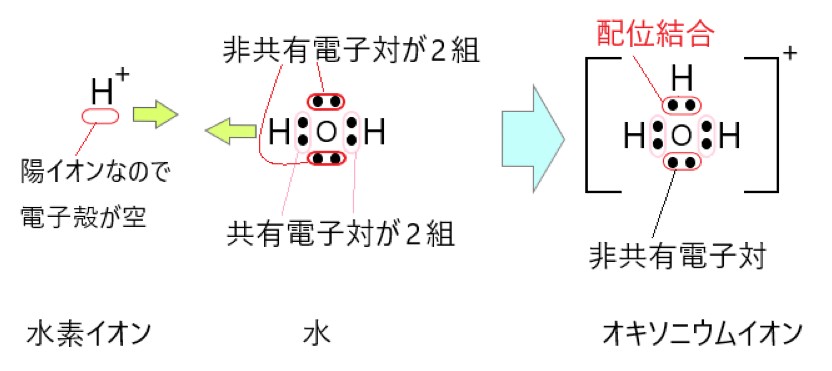
3 × 上の電子式のように、オキソニウムイオンには 3 組の共有電子対と 1 組の非共有電子対があります。
もともとは 2 組の共有電子対と 2 組の非共有電子対がありましたが、1 組の非共有電子対を提供して配位結合ができました。
配位結合と、もとからある共有結合は区別できないので、3 組の共有電子対と 1 組の非共有電子対があることになりました。
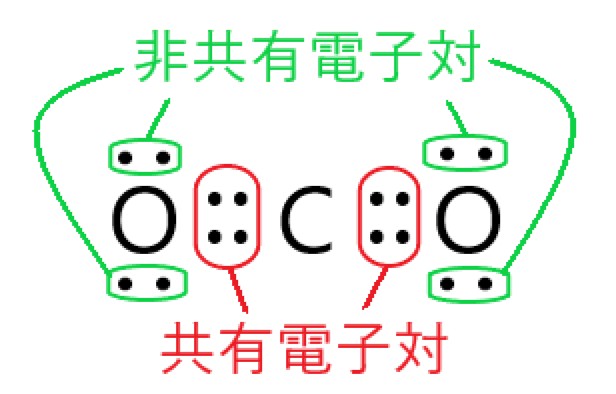
4 〇 二酸化炭素分子は、4 組の共有電子対と 4 組の非共有電子対をもちます。
問7 正解 a 2 b 5 c 1
a 2 炭酸水素ナトリウム NaHCO3 は重曹という名称で利用されています。加熱すると CO2 が発生するのでパンなどを膨らませます。
b 5 硫酸バリウム BaSO4 は水溶液中で沈殿します。
c 1 塩化カルシウム CaCl2 は乾燥剤や凍結防止剤として使用されます。
炭酸ナトリウム Na2CO3 は水に溶けると塩基性、炭酸カルシウム CaCO3 は水に溶けにくいです。
第2問
問1 正解 3
1 〇 CO の分子量は 28 、 N2 の分子量は 28 、 NO の分子量は 30 です。 CO と N2 をどの比率で混合しても平均分子量は 28 で、 NO の分子量より小さいです。
同温・同圧・同体積の気体は、気体の種類によらず物質量は等しいです。したがって、分子量の大きい気体の方が質量は大きくなります。
2 〇 CaCl2 1 mol が電離すると、Cl- イオンは 2 mol 生じます。
CaCl2 → Ca2+ + 2 Cl-
ここではモル濃度が 0.10 mol/L の CaCl2 水溶液が 2.0 L あるので、Cl- の物質量は
0.10[mol/L] × 2.0[L] × 2 = 0.40[mol]
3 × H2O の分子量は 18 であり、 18 g あるので物質量は 1 mol です。 CH3OH の分子量は 32 であり、 32 g あるので物質量は 1 mol です。
H2O 1 分子内に水素原子は 2 個あるので、 18 g の H2O には水素原子が 2 mol あります。
CH3OH 1 分子内に水素原子は 4 個あるので、 32 g の CH3OH には水素原子が 4 mol あります。
4 〇 炭素を燃焼させたときの化学反応式は、次の通りです。
C + O2 → CO2
酸素が 1 mol 燃焼に使われると、CO2 が 1 mol 発生します。
問2 正解 2
亜鉛に塩酸を加えたときの化学反応式は
Zn + 2 HCl → ZnCl2 + H2
したがって、 0.020 mol の Zn に 0.040 mol の HCl を加えると、反応が完全に終わります。
HCl の濃度は 2.0 mol/L なので、加えた塩酸 V1 は
2.0[mol/L] × V1[L] = 0.040[mol]
よって V1 = 0.020 L
また、発生した水素は 0.020 mol です。
0 ℃、1.013 × 105 Pa の条件で 1 mol の水素は 22.4 L ですから
V2[L] = 22.4[L] × 0.020[mol] ≒ 0.45[L]
問3 正解 5
中和後の塩が塩基性になるということは、弱酸と強塩基を中和しています。
リン酸 H3PO4 は弱酸、塩化ナトリウム NaOH は強塩基です。
1 × 塩酸 HCl は強酸で、水酸化ナトリウム NaOH も強塩基です。
生成するのは強酸と強塩基の塩 NaCl なので、水溶液は中性です。
2 × 塩酸 HCl は強酸で、アンモニア NH3 は弱塩基です。
生成するのは強酸と弱塩基の塩 NH4Cl なので、水溶液は酸性です。
3 × 硝酸 HNO3 は強酸で、アンモニア NH3 は弱塩基です。
生成するのは強酸と弱塩基の塩 NH4NO3 なので、水溶液は酸性です。
4 × 硫酸 H2SO4 は強酸で、水酸化カルシウム Ca(OH)2 も強塩基です。
強酸と強塩基が過不足なく中和した塩なので、生成するのは硫酸カルシウム CaSO4 です。CaSO4 は水溶液に溶けにくいです。水溶液は中性です。
5 〇 リン酸 H3PO4 は弱酸で、水酸化ナトリウム NaOH は強塩基です。
これらが過不足なく中和して生成した塩は、リン酸ナトリウム Na3PO4 です。
弱酸と強塩基からできた塩の水溶液なので、塩基性を示します。
Na3PO4 は水溶液中で電離して、Na+ と PO43- になります。
PO43- は水溶液中で一部が次のように反応し、OH- を生じます。
PO43- + H2O → HPO42- + OH-
問4 正解 4
1 〇 酢酸は弱酸で、一部が電離します。
2 〇 0.10 mol/L の水酸化ナトリウム水溶液では、OH- イオンの濃度は
[OH-] = 1.0 × 10-1 mol/L水のイオン積は
Kw = [H+] [OH-] = 1.0 × 10-14 mol2/L2
ですから
[H+] = 1.0 × 10-13 mol/Lとなり、pH = 13 となります。
3 〇 この操作で 50 倍に希釈しています。濃度は\(\frac{1}{50}\)になります。
4 × 水酸化ナトリウムは 1 価の塩基、酢酸は 1 価の酸です。
酢酸の濃度を a [mol/L] とすると、中和点では
0.10[mol/L] × 1 × \(\frac{10[ml]}{1000[ml]}\) = a[mol/L] × 1 × \(\frac{20[ml]}{1000[ml]}\)
となります。
これを解くと
a = 0.050 mol/L
実際の酢酸水溶液の濃度は 0.050[mol/L] です。
問5 正解 4
1 〇 顔を近づけて薬品のにおいを鼻で直接かぐと、有毒な気体を大量に吸ってしまう可能性があるので危険です。一度に大量の薬品を吸い込まないように、手であおいでにおいをかぎます。
2 〇 薬品が皮膚についた場合は、すぐに大量の水で薬品を洗い流します。
3 〇 濃塩酸は毒性のある揮発性(蒸発しやすい)の液体なので、換気のよい場所で扱います。
4 × 濃硫酸を水で希釈するときは、大きな熱量が発生します。濃硫酸に水を垂らすと、水が沸騰して飛び散り危険です。ビーカーの純水に少しずつ濃硫酸を加えて希釈します。
5 〇 突沸(いきなり沸騰すること)などで薬品が飛び出る可能性があるので、試験管の口の方向には人がいないようにします。
問6 正解 1
1 ×
この反応式は
Br2 + H2 → 2 HBr
臭素の酸化数は 0 → -1 であり、還元されています。
2 〇
陰極では
2 H+ + 2 e- → H2
の反応が起きています。
水素の酸化数は +1 → 0 であり、還元されています。
3 〇
この反応式は
2 Na + 2 H2O → 2 NaOH + H2
ナトリウムの酸化数は 0 → +1 であり、酸化されています。
4 〇
鉛蓄電池の放電時の正極の反応は
PbO2 + 4 H+ + SO42- + 2 e- → PbSO4 + 2 H2O
正極の Pb の酸化数は +4 → +2 であり、還元されています。
