もくじ
第1問
問1 正解 a 1 b 2
a
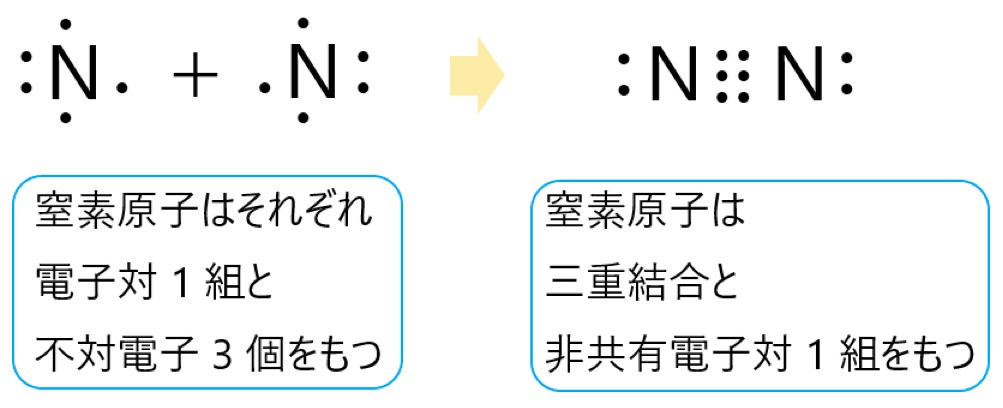
1 〇 窒素原子 N は 15 族元素であり、価電子は(最外殻電子数は) 5 個です。そこで下の電子式のように、電子対が 1 組と不対電子が 3 個あります。
この窒素原子が 2 個結合してできる窒素分子 N2 は、それぞれの不対電子 3 個が共有結合をつくります。
これにより三重結合ができます。それぞれの窒素原子は、3 つの共有結合(三重結合)と 1 つの非共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
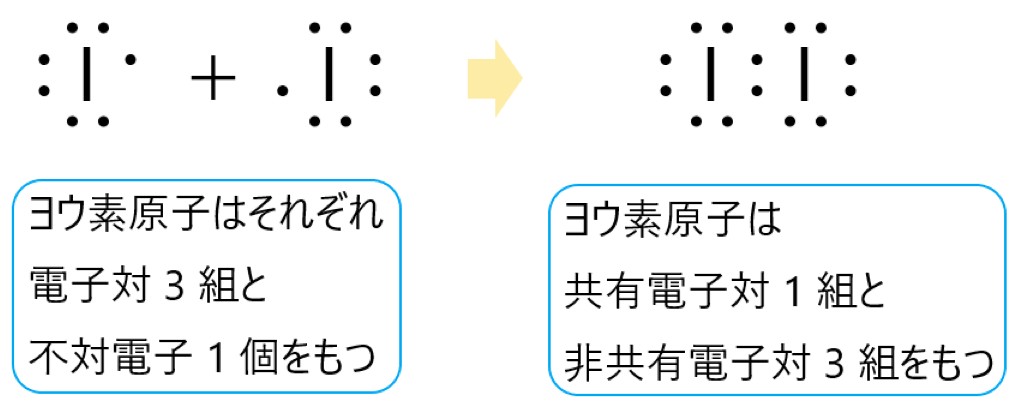
2 × ヨウ素原子 I は 17 族元素であり、価電子は(最外殻電子数は) 7 個です。そこで下の電子式のように、電子対が 3 組と不対電子が 1 個あります。
このヨウ素原子が 2 個結合してできるヨウ素分子 I2 は、それぞれの不対電子 1 個が共有結合をつくります。
これにより 1 つの単結合ができます。それぞれのヨウ素原子は、1 つの共有結合と 3 つの非共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
3 × C2H4 はエチレン分子です。
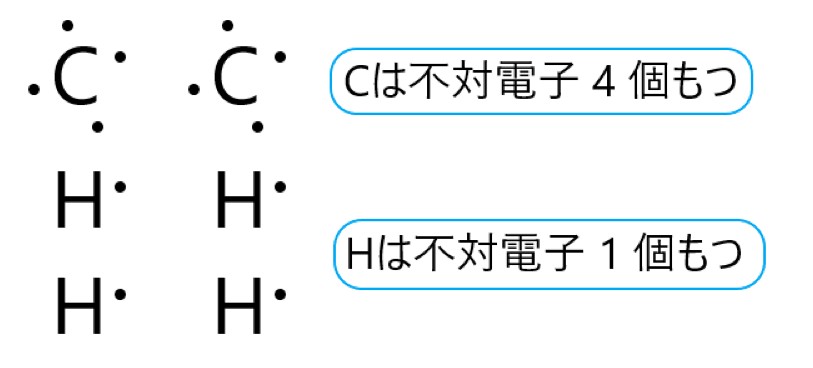
炭素原子 C は 14 族元素であり、価電子は(最外殻電子数は) 4 個です。そこで下の電子式のように、不対電子が 4 個あります。
水素原子 H は 1 族元素であり、価電子は(最外殻電子数は) 1 個です。そこで下の電子式のように、不対電子が 1 個あります。
これら炭素原子 2 個と水素原子 4 個から、1 つのエチレン分子ができます。
炭素原子同士は 2 つの共有結合(二重結合)をつくります。炭素原子と水素原子は、それぞれが不対電子を 1 個ずつ出して共有結合をつくります。
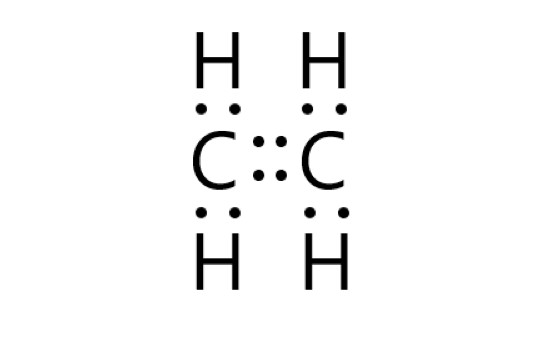
エチレン分子内の炭素原子は、1 つの二重結合と 2 つの共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
エチレン分子内の水素原子は、1 つの共有電子対があるので、最外殻に 2 個の電子をもつことになり、安定します。
(K 殻に 2 個の電子が入ったヘリウムの電子配置をとると、水素原子は安定します。)
4 × C2H6 はエタン分子です。
炭素原子 C は 14 族元素であり、価電子は(最外殻電子数は) 4 個です。そこで下の電子式のように、不対電子が 4 個あります。
水素原子 H は 1 族元素であり、価電子は(最外殻電子数は) 1 個です。そこで下の電子式のように、不対電子が 1 個あります。
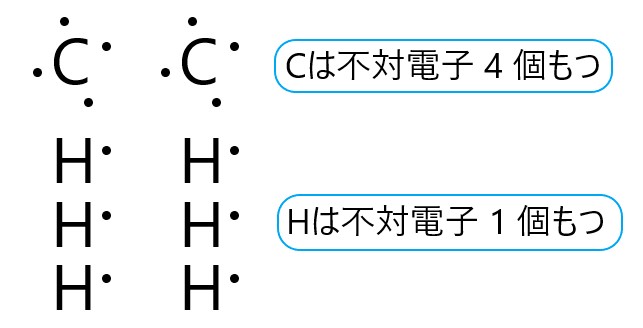
これら炭素原子 2 個と水素原子 6 個から、1 つのエタン分子ができます。
炭素原子同士は、それぞれが不対電子を 1 個ずつ出して共有結合をつくります。炭素原子と水素原子は、それぞれが不対電子を 1 個ずつ出して共有結合をつくります。
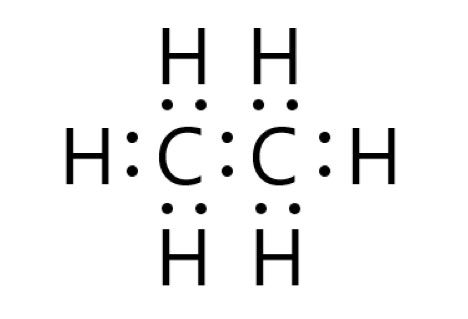
エタン分子内の炭素原子は、4 つの共有電子対があるので、最外殻に 8 個の電子をもつことになり、安定します。
エチレン分子内の水素原子は、1 つの共有電子対があるので、最外殻に 2 個の電子をもつことになり、安定します。
(K 殻に 2 個の電子が入ったヘリウムの電子配置をとると、水素原子は安定します。)
b
1 × カリウムは金属なので、カリウムの単体でできた結晶は金属結晶です。
2 〇 ナフタレンは、分子式が C10H8 で表される分子(有機化合物)です。
ナフタレン分子は、分子間力で結晶をつくっています。ナフタレンは固体から気体に昇華する性質を持ち、防虫剤などの用途があります。
3 × 硝酸ナトリウム NaNO3 は、陽イオンのナトリウムイオン Na+ と陰イオンの硝酸イオン NO3- からできています。
これらのイオンがクーロン力によりイオン結合して、イオンが規則正しく並んでイオン結晶となっています。
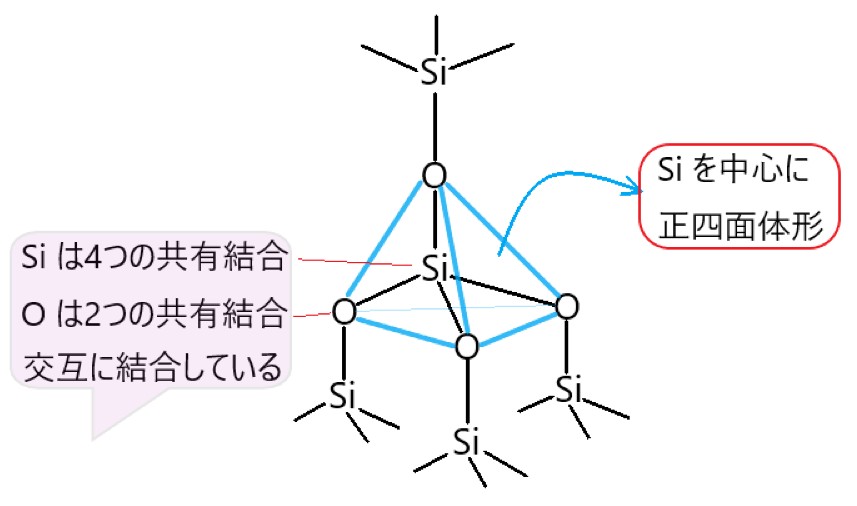
4 × 二酸化ケイ素 SiO2 は、共有結合による結晶です。
ケイ素 Si 原子は価電子が 4 個なので、4 つの共有結合をつくります。また酸素 O 原子は価電子が 6 個で不対電子が 2 個あり、2 つの共有結合をつくります。
Si の共有結合は、正四面体の頂点の方向に向いています。Si と O が交互に共有結合して、大きな共有結合の結晶をつくっています。
問2 正解 5
1 〇 塩化物イオン Cl- は、原子番号 17 の塩素原子 Cl が電子を 1 個受け取ってできたイオンです。そのため電子は 18 個あり、原子番号 18 のアルゴンと同じ電子配置になります。
2 〇 ナトリウムは原子番号 11 で、電子は K 殻に 2 個、L 殻に 8 個、M 殻に 1 個入っています。ナトリウムイオン Na+ になると M 殻の電子が失われて、最外殻が L 殻になります。
このように原子核を取り囲む電子殻が少なくなるので、ナトリウム原子の陽イオンの大きさは、もとの原子より小さくなります。
3 〇 陽子の数が等しい原子ということは、同じ原子番号であり、同じ元素です。
同じ元素なら中性子の数が異なっても(これを同位体といいます)、化学的性質はほとんど変わりません。
4 〇 陽子と中性子の質量はほとんど変わりません。そこで、原子の質量数は陽子と中性子の和としています。
質量数 = 陽子の数 + 中性子の数
5 × L 殻には最大 8 個、M 殻には最大 18 個の電子が入ります。
電子殻に入る電子の数 = 2n2
で表されます。
n = 1,2,3‥‥の整数で、内側の電子殻からこれに当てはまります。K 殻は n = 1、L 殻は 2 、M 殻は 3 、N 殻は 4 ‥‥です。
問3 正解 2
仮にそれぞれの物質 1 mol を水に溶かし、1 L の水溶液として電離するとどうなるか示します。
① K+ が 1 mol 、MnO4- が 1 mol 水溶液の中に存在します。
② Al3+ が 1 mol 、Cl- が 3 mol 水溶液の中に存在します。
③ NH4+ が 1 mol 、NO3- が 1 mol 水溶液の中に存在します。
④ Fe2+ が 1 mol 、SO42- が 1 mol 水溶液の中に存在します。
⑤ Ca2+ が 1 mol 、Cl- が 2 mol 水溶液の中に存在します。
ここで、陰イオンのモル濃度と価数の積が大きくなるものを探します。
②の 3 mol/L × 価数は 1 = 3 が最大です。
④は 1 mol/L × 価数は 2 = 2
⑤は 2 mol/L × 価数は 1 = 2
①と③は 1 mol/L × 価数は 1 = 1
問4 正解 6
水は折れ線形、アンモニアは三角錐形、メタンは正四面体形です。
これは分子の中心にある原子から見て、4 つある電子対がなるべく電気的な反発が小さくなるような構造となるためです。
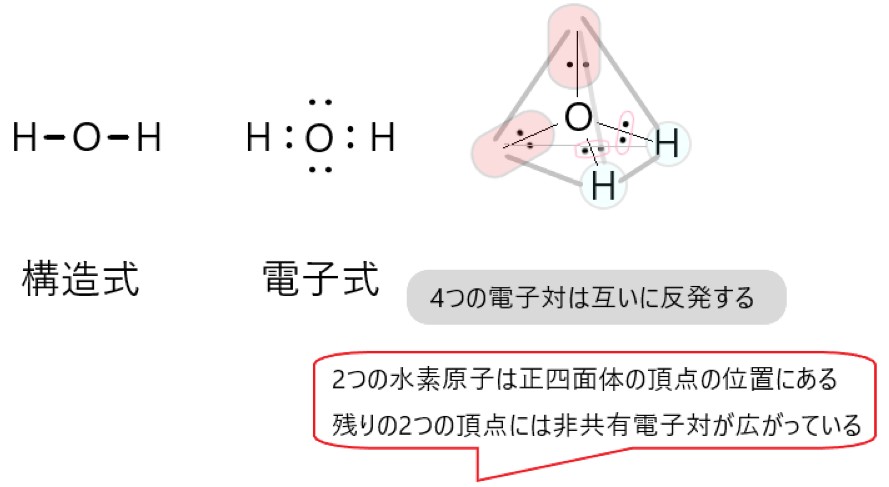
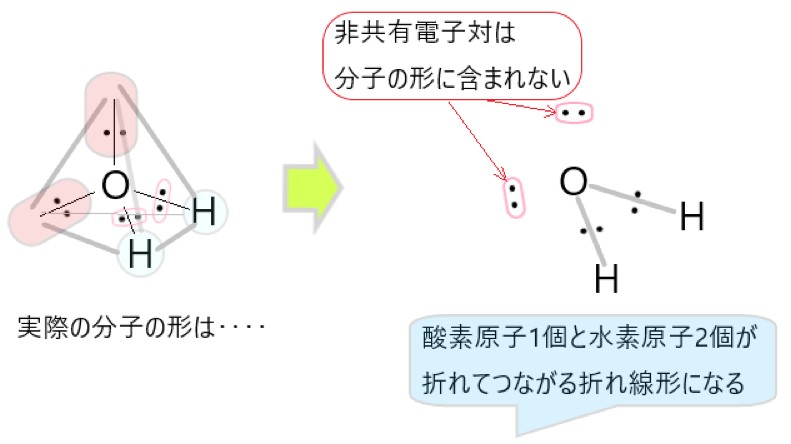
H2O では、分子の中心を酸素原子と考えると、O-H 結合をつくっている共有電子対が 2 個、酸素原子につく非共有電子対が 2 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
しかし、非共有電子対は分子の形としては見えませんので、残るのは中心の酸素原子と、そこから正四面体の頂点方向にある水素原子 2 個です。そこで水分子の形は折れ線形に見えます。
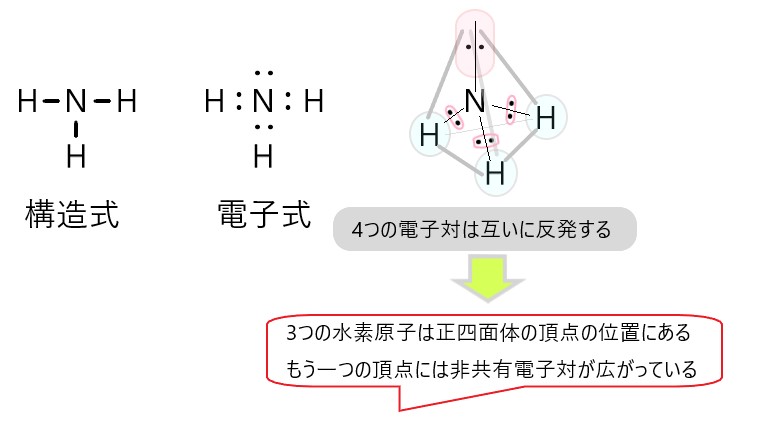
NH3 では、分子の中心を窒素原子と考えると、N-H 結合をつくっている共有電子対が 3 個、窒素原子につく非共有電子対が 1 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
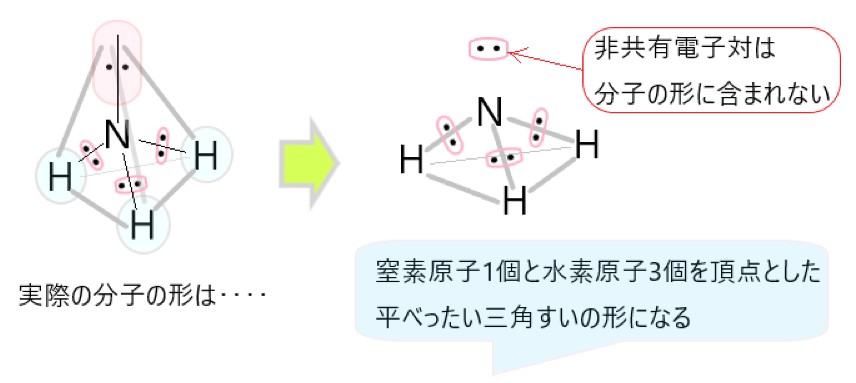
しかし、非共有電子対は分子の形としては見えませんので、残るのは中心の窒素原子と、そこから正四面体の頂点方向にある水素原子 3 個です。そこでアンモニアの形は三角錐形に見えます。
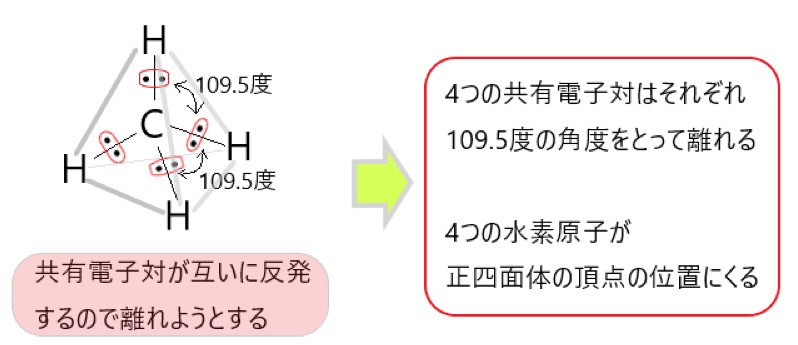
CH4 では、分子の中心を炭素原子と考えると、C-H 結合をつくっている共有電子対が 4 個あります。
この 4 つの電子対がなるべく離れるような形は、それぞれの電子対が正四面体の頂点にあるような構造です。
問5 正解 1
炭酸イオン CO32- が 0.050 mol 存在するので、炭酸ナトリウム Na2CO3 も 0.050 mol あることがわかります。
炭酸ナトリウムのモル質量は 106 g/mol なので、0.050 mol の質量は
106[g/mol] × 0.050[mol] = 5.3[g]
混合物の残りが NaOH なので求める質量は
9.3 - 5.3 = 4.0[g]
問6 正解 4
物質そのものが変わる変化を、化学変化といいます。物質そのものは変化せず、状態などが変わる変化を、物理変化といいます。
固体が溶液の中に溶けるとき、固体が小さな粒子になって、溶液の粒子の中に混ざり込んでいきます。物質そのものは変わらないので、物理変化です。
固体・液体・気体の三態のあいだで物質が変わっているときは、物質そのものが変化したわけではないので、物理変化です。
1 × 砂糖が水に溶けただけで、物質が反応して変化したわけではありません。水が蒸発すると溶けていた砂糖が結晶化して固体として現れます。
2 × 液体の水が気体の水になっただけで、物質が変化したわけではありません。湯気は気体の水(水蒸気)が冷えて液体の水の微粒子になったものです。
3 × ドライアイスが固体から気体になって(昇華)、固体の量が減っただけなので物質に変化はありません。
4 〇 貝殻は主成分が炭酸カルシウム CaCO3 で、希塩酸 HCl と反応し、物質が変化します。
CaCO3 + 2 HCl → CaCl2 + H2O + CO2
炭酸カルシウムと塩酸は化学反応によって、塩化カルシウム CaCl2 と水 H2O と二酸化炭素 CO2 に変化します。
物質そのものが変化したので、④は化学変化です。
問7 正解 a 1 b 3
a
石灰水を白濁させる気体は二酸化炭素です。
石灰水には水酸化カルシウム Ca(OH)2 が溶けていて、CO2 と反応して水に溶けにくい炭酸カルシウム CaCO3 が生成します。
Ca(OH)2 + CO2 → CaCO3 + H2O
炭酸カルシウム CaCO3 が水に溶けにくいので、水溶液が白濁します。
1 × 二酸化炭素が溶けた炭酸水は弱酸性です。
2 〇 C = O 結合には極性があります。炭素原子が少し正電荷 δ+ 、酸素原子が少し負電荷 δ- をもちます。
3 〇 CO2 の炭素原子は、酸化数が +4 です。
4 〇 シュウ酸 H2C2O4 、(COOH)2 と書いてもいいです、の酸化では
H2C2O4 → 2 CO2 + 2 H+ + 2 e-
という半反応式になります。
b
実験結果から、酸化銅(Ⅱ)は還元されて銅となりました。
また、CH2 の構造が繰り返しているポリエチレンー(ーCH2ーCH2ー)nーは酸化され、水 H2O と二酸化炭素 CO2 が生成しました。
ポリエチレンが分解した生成物が還元剤としてはたらくと考えられます。
3 CuO + ( C + 2H ) → 3 Cu + CO2 + H2O
酸化銅(Ⅱ)と、ポリエチレンの分解物( C や H )が反応物です。銅 Cu と 石灰水を白濁させる二酸化炭素 CO2 と試験管内壁の水滴 H2O が生成物です。
試験管 A に入れた酸化銅(Ⅱ)は、すべて銅になりました。このとき、1 mol の酸化銅(Ⅱ)から 1 mol の銅が生成しています。
銅のモル質量は 64 g/mol なので、0.32 g の銅の物質量は
\(\frac{0.32[g]}{64[g/mol]}\) = 0.0050[mol]
酸化銅(Ⅱ)のモル質量は 80 g/mol ですから、求める質量は
80[g/mol] × 0.0050[mol] = 0.40[g]
第2問
問1 正解 3
1 × 窒素 28 g では、窒素原子の物質量は \(\frac{28[g]}{14[g/mol]}\) = 2.0[mol]となります。
酸素 28 g では、酸素原子の物質量は \(\frac{28[g]}{16[g/mol]}\) ≒ 1.8[mol]となります。
(窒素分子で考えると N2 なので、物質量は \(\frac{28[g]}{28[g/mol]}\) = 1.0[mol]
酸素分子で考えると O2 なので、物質量は \(\frac{28[g]}{32[g/mol]}\) ≒ 0.88[mol])
いずれにせよ物質量は等しくありません。
2 × 気体の水素分子は H2 なので、分子量は 2.0 です。
水素 1.0 g の物質量は \(\frac{1.0[g]}{2.0[g/mol]}\) = 0.50[mol] となります。
気体の性質として、0 ℃、1.013 × 105 Pa の条件下では、1 mol の気体の体積が 22.4 L です。
ここでは水素は 0.50 mol なので、体積は 11.2 L です。
3 〇 一酸化炭素と酸素が反応して二酸化炭素が生成する反応式は
2 CO + O2 → 2 CO2
つまり、2 mol の一酸化炭素と 1 mol の酸素が反応して、2 mol の二酸化炭素が生成しています。
はじめに 3 mol の混合気体があり、反応後に 2 mol の気体になったのですから、気体の総物質量は減少しています。
4 × 容器は密閉されていて、外部との物質の出入りはありません。内部で化学反応が起こったとしても、内部の物質(原子)そのものは増減しないので、容器全体の質量は一定です。
問2 正解 3
各原子ごとに、両辺で数がそろうように式を立てます。
炭素原子から考えます。左辺に CH4 分子のなかに 1 個あります。右辺には CO2 分子のなかに 1 個あります。
それぞれに係数をかけて、両辺の数をそろえると
a × 1 = d × 1
C: a = d
同様に水素原子と酸素原子で考えます。
水素原子を考えます。
左辺に CH4 分子のなかに 4 個あります。H2O のなかに 2 個あります。
右辺には H2 分子のなかに 2 個あります。
それぞれに係数をかけて、両辺の数をそろえると
H: 4a + 2b = 2c
酸素原子を考えます。
左辺に H2O 分子のなかに 1 個あります。
右辺には CO2 分子のなかに 2 個あります。
それぞれに係数をかけて、両辺の数をそろえると
O: b = 2d
が成り立ちます。
ここで仮に a = 1 とすると、順番に d = 1、b = 2、c = 4 となり、すべての係数が定まります。
問3 正解 2
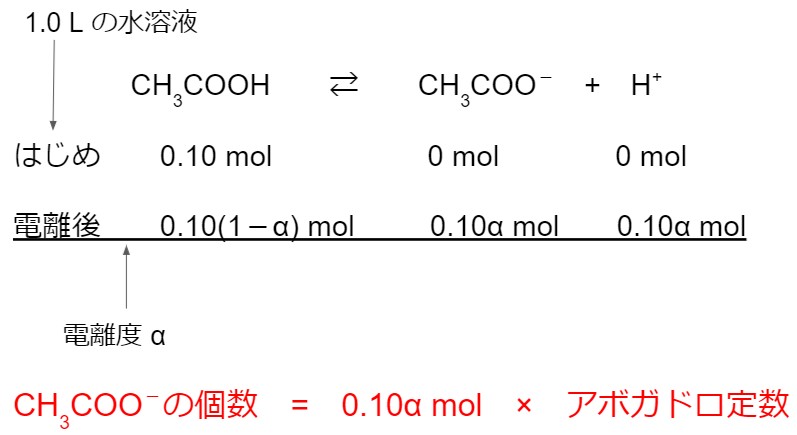
下の化学反応式のように、酢酸は水溶液中で一部が電離します。
CH3COOH ⇆ CH3COO- + H+
はじめに 0.10 mol/L の酢酸水溶液が 1.0 L あったので、酢酸は 0.10 mol ありました。
酢酸イオン CH3COO- と水素イオン H+ は 0 mol です。
CH3COOH ⇆ CH3COO- + H+
0.10 mol 0 mol 0 mol
この水溶液中の酢酸の電離度は α = 1.6 × 10-2 です。
十分に時間がたつと、この電離した水溶液中では、酢酸の物質量は 0.10(1-α) mol となります。
酢酸イオン CH3COO- と水素イオン H+ の物質量は 0.10 α mol となります。
CH3COOH ⇆ CH3COO- + H+
0.10(1-α) 0.10 α 0.10 α
求める酢酸イオンの個数は、酢酸イオンの物質量とアボガドロ定数の積として計算できます。
したがって、
0.10 [mol] × 1.6 × 10-2 × 6.0 × 1023 [/mol] = 9.6 × 1020 [個]
となります。
問4 正解 4
実験では、2 価の弱酸であるシュウ酸 H2C2O4 を、1 価の強塩基である水酸化ナトリウム NaOH で中和滴定します。
フェノールフタレインの変色域はおおよそ pH 8.0 ~ 9.8 で、pH = 8.0 より酸性側で無色で、pH = 9.8 より塩基性側で赤くなります。
シュウ酸と水酸化ナトリウムの中和反応は
H2C2O4 + 2 NaOH → Na2C2O4 + 2 H2O
となります。
(シュウ酸は (COOH)2 と書いてもよいので、下のような化学反応式でもかまいません。)
(COOH)2 + 2 NaOH → (COO)2Na2 + 2 H2O
中和点における水酸化ナトリウムの滴下量を X ml とすると、
0.10[mol/L] × \(\frac{10[ml]}{1000[ml]}\) × 2価 = 0.10[mol/L] × \(\frac{X[ml]}{1000[ml]}\) × 1価
X = 20
まとめると、水酸化ナトリウム水溶液の滴下量は 20 mL です。
また、中和点 ( 20 mL ) 以前は pH 8.0 ~ 9.8 のフェノールフタレインの変色域に入らず無色で、中和点を超えると塩基性側に移り、水溶液は赤色となります。
これらを満たすのは④です。
問5 正解 3
中和滴定実験の流れを確認します。
Ⅰ まず標準溶液(濃度が正確にわかっている溶液のこと)をビュレットに入れます。
標準溶液は既に濃度が正確に決まっているので、ビュレット内でも濃度が変わらないようにします。
ですから、ビュレットを純水で洗ってそのまま使うと、ビュレットの内壁に残った水滴で標準溶液が薄まってしまい、標準溶液の濃度が変わってしまいます。
そのためビュレットを純水で洗ったあと、ビュレットの内壁を標準溶液ですすぎます。
ビュレットの内壁を標準溶液で流しておくことで、このあと標準溶液をビュレットに入れても濃度は変わりません。
Ⅱ 試料溶液(濃度がわからないので、中和滴定でこの濃度を調べます)をホールピペットで採取して、コニカルビーカーに入れます。
ホールピペットは、正確に一定量の液体を吸い上げてはかり取る器具です。
そのため、ホールピペットを純水で洗ってそのまま使うと、ホールピペットの内壁に水滴が残ってしまいます。
水滴が残ったまま試料溶液をホールピペットで吸い上げると、わずかに試料溶液に純水が混ざります。
すると、一定量の試料溶液を正確にはかり取るはずが、水滴が混ざった分だけ試料溶液の体積が少なくなってしまいます。
試料溶液の量が正確にはかり取れないと、誤差になります。
ですから、ホールピペットは純水で洗ったあと、試料溶液ですすぎます。ホールピペットの内壁に試料溶液の水滴が残っていても、試料溶液は正確な量をはかり取ることができます。
Ⅲ ホールピペットではかり取った試料溶液を、コニカルビーカーに移すときの注意。
一定量の試料溶液を、ホールピペットで正確にはかり取ることができました。そのあと、コニカルビーカーに正確な量の試料溶液を移します。
コニカルビーカーを純水で洗い、そこにホールピペットで試料溶液を入れます。水滴が残っていても、コニカルビーカーに入れた試料溶液の量は一定のままです。
もしコニカルビーカーを純水で洗い、さらに試料溶液ですすいでいたら、コニカルビーカーには試料溶液の水滴が残ってしまいます。
試料溶液の水滴が残っているコニカルビーカーに、ホールピペットで試料溶液を入れると、コニカルビーカー内の試料溶液の体積は、はかり取った一定量より大きくなってしまいます。
ですから、コニカルビーカーは純水で洗うだけで、試料溶液ですすぐことはありません。
Ⅳ ビュレットの目盛りを読み取るときは、ビュレットの内側の液面と、読み取る視線を一直線になるようにします。
つまりビュレット内の液面と目の高さを合わせ、液面の延長線上に自分の目があるようにして、液面と自分が読み取る視線を一致させます。
Ⅴ 目盛りを読み取って記録するとき、ビュレットについている目盛りより 1 桁下まで読み取ります。
ビュレットの最少目盛りが 0.1 mL ならば、目分量で 0.01 mL の位まで読み取ります。
例えば 8.4 mL と 8.5 mL の間に液面があるときは、さらに自分で目盛りの間を 10 等分しておおよそ読み取り、8.44 mL などと記録します。
1 〇 ビュレット内の標準溶液の濃度が水で薄まると正確な実験ができないので、水滴を標準溶液で洗い流します。
2 〇 ホールピペットは試料溶液を正確にはかりとる器具です。内部が水でぬれていると試料溶液が薄まってしまうので、ホールピペット内をあらかじめ試料溶液で洗い流します。
3 × コニカルビーカーには正確にはかりとった量の試料溶液を入れます。コニカルビーカーを試料溶液ですすいでしまうと、試料溶液の量が増えてしまい正確な実験ができません。
4 〇 液面の高さに目を合わせて、水平な視線で目盛りを読み取ります。
5 〇 最少目盛りの 1 桁下まで数値を読み取ります。
問6 正解 1
酸化数は、化合物内の水素原子が +1 、酸素原子が -2 となるのが基本です。アルカリ金属の原子は +1 とします。
そのほか、
化合物を構成する各原子の酸化数の総和はゼロになる
イオンとなった原子の電荷とその原子の酸化数は等しい
多原子イオンの電荷とイオンを構成する各原子の酸化数の総和は等しい
といった原則があります。
1 酸化数は H = +1 、 O = -2 、 HClO4 は全体で酸化数が 0 です。
これより
(+1) + Cl + (-2) × 4 = 0
となります。
したがって Cl の酸化数は、Cl = +7
2 酸化数は H = +1 、 O = -2 、 H3PO4 = 0 です。
1 と同様に計算すると、P の酸化数は、P = +5
3 酸化数は K = +1 、 O = -2 、 KNO3 = 0 です。
これより N の酸化数は、N = +5
4 酸化数は Na = +1 、 O = -2 、 Na2SO4 = 0 です。
これより S の酸化数は、S = +6
