もくじ
第1問
問1 正解 4
それぞれの分子の構造式は以下の通りです。
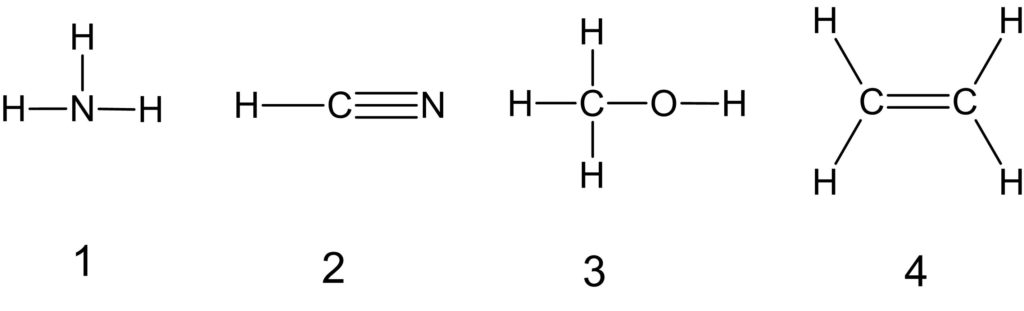
分子内の共有結合を数えると、NH3 は 3 個、HCN は 4 個、CH3OH は 5 個、C2H4 は 6 個です。
このように、共有結合に使われている電子の総数が最も多いのは、エチレン C2H4 です。
なお、1 つの共有結合は 2 個の電子でつくられているので、C2H4 では 12 個の電子が共有結合に使われています。
そのほかの分子では、 NH3 は 6 個、HCN は 8 個、CH3OH は 10 個の電子が共有結合に使われています。
問2 正解 1
1 × 同位体は陽子の数が等しく(つまり原子番号は同じです)、中性子の数が異なります。
2 〇 同位体は中性子の数が異なります。中性子の数が異なるので質量数が違います。
3 〇 中性子は化学反応にほとんど関係ないので、中性子の数が異なっても化学的性質はほぼ同じです。
4 〇 記述のとおり、放射線を放出して原子が崩壊し、放射性同位体の量が半分に減るまでの時間を半減期といいます。
問3 正解 4
1 〇 同じ周期の元素では、原子番号が 1 大きくなると、最外殻電子数は 1 増えます。
2 〇 He は最外殻の電子数が 2 個、Ne と Ar は最外殻の電子数が 8 個で、価電子は 0 個となります。
3 〇 第 2 周期と第 3 周期の同族の元素では原子番号が 8 ずれているので、陽子数の差は 8 個です。
4 × イオン化エネルギーは、電子 1 個を取り去るために必要なエネルギーです。イオン化エネルギーは、周期表の左下の元素が小さい傾向です。
原子核(陽子)から遠い位置にある電子の方が、近い位置にある電子より離れやすいので、同族元素では原子番号が大きいとイオン化エネルギーは小さくなります。
問4 正解 3
1 〇 金属は展性(叩いて薄く広げられる)や延性(引っ張って細く伸ばせる)という性質を持ちます。
2 〇 共有結合は強固なので、共有結合が切れて水に溶けるということは起こりにくいです。
ダイヤモンドや黒鉛、水晶など共有結合結晶の例を思い浮かべると、水に溶けにくいと判断できます。
3 × イオン結晶は固体の状態では電気を通しにくいです。イオン結晶を溶液に溶かすか、融解させて液体の状態にすると、電気を通します。
4 〇 分子結晶は結合する力が弱いので、結晶も柔らかくなります。
問5 正解 3
水溶液の密度が 1.2[g/cm3] で 50[mL] あるので、この水溶液の質量は
1.2[g/cm3] × 50[cm3] = 60[g] です。
質量パーセント濃度が 20 % なので、この水溶液に溶けている MgCl2 の質量は
60[g] × \(\frac{20}{100}\) = 12[g] です。
MgCl2 のモル質量は 24 + 35.5 × 2 = 95[g/mol] となります。
したがって、水溶液中の MgCl2 の物質量は
\(\frac{12[g]}{95[g/mol]}\) ≒ 0.126[mol] です。
MgCl2を 1 mol 溶かすと水溶液中の塩化物イオン Cl- は 2 mol となるので、求める塩化物イオンの物質量は
0.126[mol] × 2 ≒ 0.25[mol] です。
問6 正解 1
1 × 炭素原子は 4 つの共有結合をもち、ダイヤモンドでは正四面体形の構造が繰り返されます。
2 〇 炭素原子が球状に結合した物質をフラーレンといいますが、これは炭素の同素体です。
3 〇 黒鉛では隣接する 3 つの炭素原子と共有結合します。そのため、結合する角度が 120 度の平面上の構造となり、正六角形の構造が繰り返されます。
4 〇 黒鉛は電気を通します。
問7 正解 ア 1 イ 5
6 種類の純物質のうち、水に溶けてろ液に含まれるのは 2 種類です。
塩化カリウム KCl 、炭酸水素ナトリウム NaHCO3 が溶けます。
他の炭酸カルシウム CaCO3 、硫酸バリウム BaSO4 、鉄 Fe 、銅 Cu は水に溶けずに固体のままです。
実験Ⅰでは金属の炎色反応を調べています。
カリウムイオンは赤紫色、ナトリウムイオンは黄色です。炎の色が赤紫色なので、アは塩化カリウムと考えられます。
実験Ⅱについて、塩化カリウム以外の 5 種類の純物質との反応を考えます。
(a) 炭酸水素ナトリウム NaHCO3 に塩酸を加えると、二酸化炭素が発生します。
NaHCO3 + HCl → NaCl + H2O + CO2
二酸化炭素は空気より重く、水に少し溶け、燃焼しません。
(b) 炭酸カルシウム CaCO3 に塩酸を加えると、二酸化炭素が発生します。
CaCO3 + 2 HCl → CaCl2 + H2O + CO2
(c) 硫酸バリウム BaSO4 に塩酸を加えても反応しません。
(d) 鉄 Fe に塩酸を加えると、水素が発生します。
Fe + 2 HCl → FeCl2 + H2
水素は無色無臭で空気より軽く、水にほとんど溶けず、爆発的に燃焼します。したがってイは鉄です。
(e) 銅 Cu に塩酸を加えても反応しません。硝酸など酸化力のある酸に溶けます。
第2問
問1 正解 3
アスコルビン酸の分子量(モル質量 g/mol )は、12 × 6 + 1.0 × 8 + 16 × 6 = 176
500 mL ( = 0.500 L ) に 0.88 g 含まれているので、求めるモル濃度は
$$\frac{0.88[g]}{176[g/mol]} \times \frac{1}{0.500[L]} = 0.010 [mol/L]$$
問2 正解 2
ナトリウムと水の反応は
2 Na + 2 H2O → 2 NaOH + H2
となるので、2 mol のナトリウムと 2 mol の水が反応すると、1 mol の水素が発生します。
ナトリウムは \(\frac{0.92[g]}{23[g/mol]}\) = 0.040[mol] 存在します。
水は \(\frac{90[g]}{18[g/mol]}\) = 5.0[mol] 存在します。
水は十分あるので、ナトリウム全量と反応します。このとき水素は 0.020 mol 発生します。
水素の分子量は 2.0 なので、求める質量は 2.0[g/mol] × 0.020[mol] = 0.040[g] です。
問3 正解 5
1 〇 ブレンステッド・ローリーの定義では、水溶液中に限らず、気体状態でも水素イオンのやり取りを考えることができます。
例えばアンモニア水の入った試験管の口に、濃塩酸を付着させたガラス棒を近づけると、白煙が生じます。
これは気体となったアンモニア NH3 と、ガラス棒の先で気体となった塩化水素 HCl が反応し、塩化アルミニウム NH4Cl の微粒子が生成するためです。
結果として、NH4Cl の微粒子のまとまりが白い煙のように見えます。これは酸塩基反応です。
2 〇 弱酸の塩に強酸を加えると、弱酸が遊離します。
(例:酢酸ナトリウム CH3COONa に塩酸 HCl を加えると、酢酸が遊離します。)
CH3COONa + HCl → NaCl + CH3COOH
3 〇 酸の価数 × 酸の物質量 = 塩基の価数 × 塩基の物質量 が成り立つのが中和点です。
4 〇 純粋な水では、
H2O → H+ + OH-
と電離している以外にイオンは存在しないので、
[H+] = [OH-]となります。
5 × 塩基の価数と塩基の強弱は関係ありません。
問4 正解 2
pHは、[H+] = 1.0 × 10-pH mol/L と定義されます。
水素イオン濃度が高いほど、pHは小さくなります。
塩酸は強酸なので、水溶液中では完全に電離します。そのため、
アの水素イオン濃度は 0.010 mol/L = 1.0 × 10-2 mol/L (pH = 2)
イの水素イオン濃度は 0.0010 mol/L = 1.0 × 10-3 mol/L (pH = 3)です。
酢酸は弱酸なので、水溶液中の一部の酢酸分子だけが電離して、水素イオンを生成します。
CH3COOH ⇄ CH3COO- + H+
ウは電離度 0.020 なので、
水素イオン濃度は 0.10 × 0.020 = 0.0020 = 2.0 × 10-3 mol/L (pH ≒ 2.7)
水素イオン濃度が高いと pH は小さいので、pH の小さい順に ア < ウ < イ となります。
問5 正解 2
半反応式は次の通りです。
MnO2 + 2 e- + 4 H+ → Mn2+ + 2 H2O
2 Cl- → Cl2 + 2 e-
この 2 式を加えると
MnO2 + 2 Cl- + 4 H+ → Mn2+ + 2 H2O + Cl2
2Cl- を両辺に加えて反応式を完成させると
MnO2 + 4 HCl → MnCl2 + 2 H2O + Cl2
この酸化還元反応では、Mn 1 mol と電子 2 mol 、また Cl2 1 mol と電子 2 mol が反応しています。
そこで、0.25 mol の Cl2 が発生したとき、 Mn が受け取る電子は 0.50 mol です。
問6 正解 2
ア
過酸化水素は酸化剤として作用しています。
半反応式は次の通りです。
H2O2 + 2 H+ + 2 e- → 2 H2O
H2S → S + 2 H+ + 2 e-
これらの 2 式を加えてできる反応式は
H2O2 + H2S → S + 2 H2O
となります。このとき水溶液中で生成した S のために白濁します。
イ
ヨウ化カリウムは還元剤として作用しています。
半反応式は次の通りです。
H2O2 + 2 H+ + 2 e- → 2 H2O
2 I- → I2 + 2 e-
これらの 2 式を加えてできるイオン反応式は
H2O2 + 2 H+ + 2 I- → 2 H2O + I2
両辺に 2 K+ と SO42- を加えて式を整理すると
H2O2 + H2SO4 + 2 KI → I2 + 2 H2O + K2SO4
となります。
このとき水溶液中で生成したヨウ素 I2 とヨウ化物イオン I- から、三ヨウ化物イオン I3- が生じます。
この三ヨウ化物イオンにより、水溶液の色が褐色となります。
ウ
二酸化炭素は酸化剤として作用しています。
二酸化炭素分子のなかの炭素原子が還元されて単体となることで、黒色の炭素が生成します。
CO2 + 2 Mg → C + 2 MgO
二酸化炭素はマグネシウムに酸素を与えています。このとき CO2 の炭素原子の酸化数は +4 から 0 へ変化しています。
