金属の原子が規則正しく配列している固体を、金属結晶といいます。
金属原子の電子は自由に原子の周囲を移動しており、この電子を自由電子といいます。
自由電子が金属原子同士を結びつけています。この結合を金属結合といいます。
金属結晶は金属結合によってできています。
金属は金属光沢をもち、電気や熱の伝導性が高く、展性や延性を示します。
もくじ
金属結晶
金属の原子が規則正しく配列している固体を、金属結晶といいます。
原子には、中心に正の電荷をもつ原子核があり、周囲に負の電荷をもつ電子があります。金属結晶では、周囲の電子に特徴があります。
自由電子でできた金属結合
原子核の周りにある電子は、電子殻に収容されています。金属の原子では、外側の電子殻にある電子の一部が、他の原子の電子殻と重なっています。
そのため金属原子のもつ電子は、他の原子の電子殻に移ったり、戻ったりします。金属原子の電子は自由に原子の周囲を移動しており、この電子を自由電子といいます。

自由電子が金属原子の間を動いて原子を引きつける働きをするので、金属原子同士が固定されます。このように金属原子同士が結びついていることを、金属結合といいます。
金属結晶は金属結合によってできています。また金属結晶は、原子が繰り返し規則正しく並んでいるので、イオン結晶と同じく組成式で表します。
金属の特徴
金属結晶は、自由電子による金属結合でできています。この自由電子により、金属はいくつかの特徴をもちます。
①金属光沢
金属の表面は輝くように見え、光沢をもちます。
これは、金属表面に光が当たると自由電子が動き、自由電子から光が発生するためです。金属に自由電子があることで光が反射し、金属に光沢が生じます。

②電気・熱伝導性
金属はよく電気や熱を伝えます。
金属には自由に動ける自由電子があるので、電気を容易に伝えます。自由電子を介して熱も伝えるので、金属は熱伝導性が高いです。
電気伝導性が一番高い金属は、銀 Ag です。次に電気をよく通すのは、銅 Cu です。
同じく熱伝導性が一番高い金属は、銀です。次によく熱を伝えるのは、銅です。
③展性・延性
金属結合は自由電子で結びついているので、原子の位置がずれても自由電子が原子同士をつなぎとめていれば、金属結晶は保たれます。
このように金属は、自由電子があることで、変形させても金属のままです。
金属を叩いて力を加えると、金属は薄く広がります。この性質を展性といいます。
また、金属を引き延ばすと、細長い金属の線になります。この性質を延性といいます。
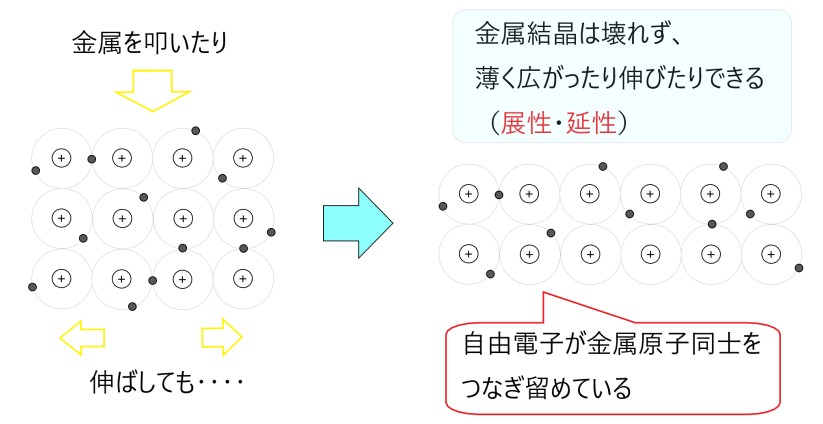
展性や延性は、金属の代表的な特徴です。
展性・延性が最大の金属は、金 Au です。次に展性・延性が大きいのは、銀 Ag です。
問題演習
確認テスト1
次の文章の空欄に適切な語句を入れましょう。
金属の原子が規則正しく並んでいる固体を、( A )といいます。
金属の原子では、最外殻にある電子は他の原子の電子殻と重なりがあり、金属原子の電子は金属全体を移動できます。この電子を( B )といいます。
( B )が存在することで、金属原子同士は決まった距離で固定されています。このような金属の結合を( C )といいます。
金属は( B )をもつことで、特徴的な性質を示します。金属の表面に光が当たると、反射して輝いて見えます。この性質を( D )といいます。
また金属は、電気伝導性が( E 高く・低く )、熱伝導性は( F 高い・低い )です。最も電気伝導性が高い金属は( G )です。
金属は、力を加えて薄く広げることができます。この性質を( H )といいます。また、細長く引き伸ばすこともできます。この性質を( I )といいます。金属のなかで一番( H )や( I )が大きいのは、( J )です。
実践問題1(2016本第1問問4)
化学結合に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
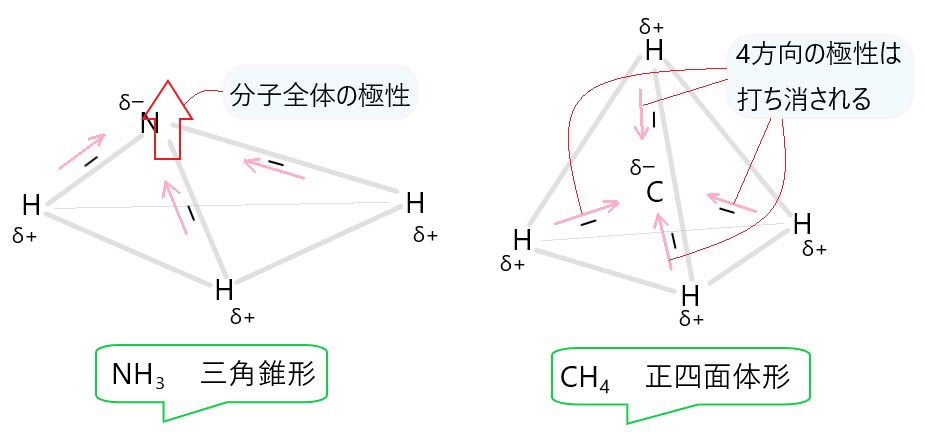
① 無極性分子を構成する化学結合の中には極性が存在するものもある。
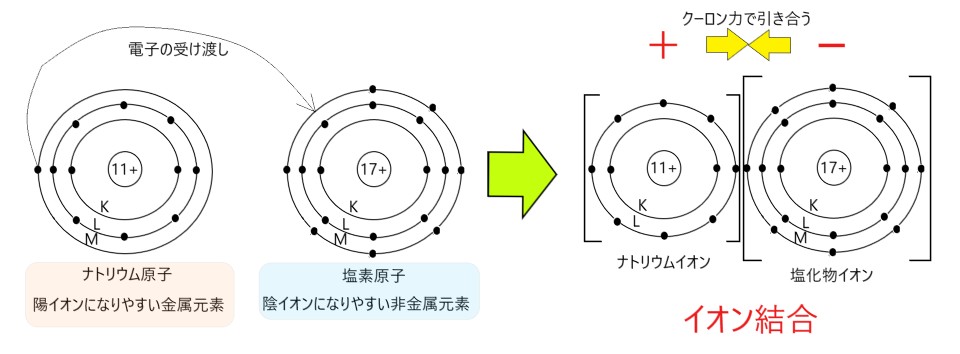
② 塩化ナトリウムの結晶では、ナトリウムイオン Na+ と塩化物イオン Cl- が静電気的な力で結合している。
③ 金属が展性・延性を示すのは、原子どうしが自由電子によって結合しているからである。
④ 二つの原子が電子を出し合って生じる結合は、共有結合である。
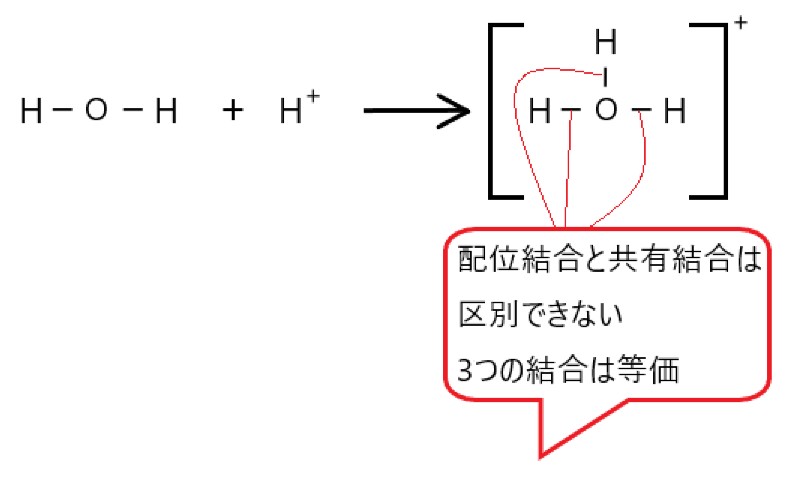
⑤ オキソニウムイオン H3O+ の三つの O-H 結合のうち、一つは配位結合であり、他の二つの結合とは性質が異なる。
(2016年度センター試験 本試験 化学基礎 第1問問4 より引用)