共有結合をつくっている原子が、その共有電子対をどれだけの力で引き寄せるかを示したのが電気陰性度です。
電気陰性度は数値で表し、数値が大きいほど共有電子対を強く引きつけます。
共有電子対が一方の原子に寄ると、共有結合の電荷も偏ります。共有結合の電荷に偏りがあることを、極性があるといいます。
結合に極性があり、分子全体で電荷の偏りがあるとき、その分子を極性分子といいます。
分子全体で極性がないとき、その分子を無極性分子といいます。
もくじ
電気陰性度
原子によって、共有結合をつくっている共有電子対を引きつける力の強さが違います。原子が共有電子対を引きつける力の強さを電気陰性度といい、数値で表します。
電気陰性度はその数値が大きいほど、共有電子対を強く引きつけます。一般に電気陰性度は周期表の右上の元素ほど大きく、左下の元素ほど小さくなります。(希ガスは除きます。)
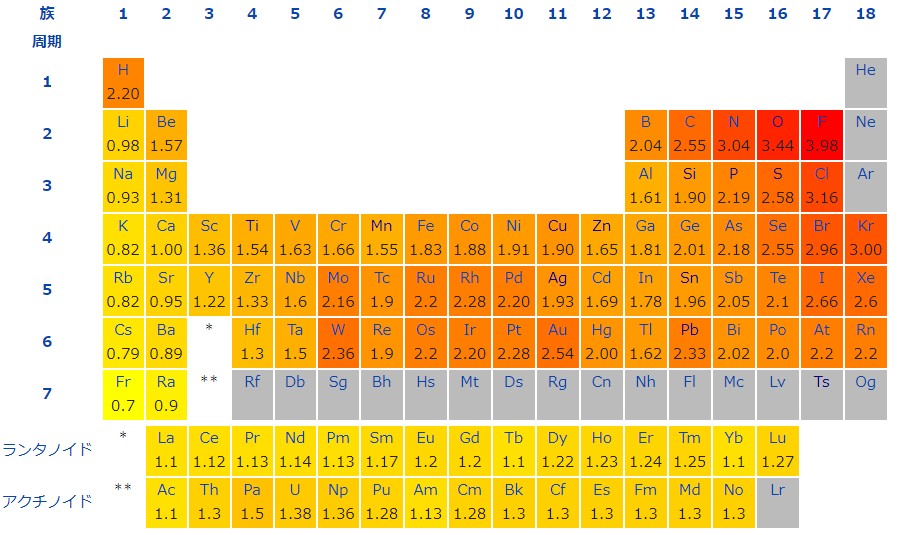
具体的に言えば、電気陰性度が最大なのはフッ素 F で、フッ素原子が最も強く電子対を引きつけます。
同一周期なら右の元素ほど電気陰性度は大きいので、第2周期元素の例ではフッ素 F が最大で、次に酸素 O 、窒素 N 、炭素 C ‥‥となります。
同族元素なら上の元素ほど電気陰性度は大きいので、ハロゲンの例ではフッ素原子 F が最大で、次に塩素 Cl 、臭素 Br 、ヨウ素 I ‥‥となります。
その他に覚えておくべきなのは水素原子 H で、水素原子の電気陰性度は炭素 C や硫黄 S 、ヨウ素 I より小さいです。
そのため水素原子は、他の非金属元素と共有結合したときはたいてい電気陰性度は小さい、と知っておきましょう。

なお、それぞれの元素が示す電気陰性度の大きさは、これまでに学習したイオン化エネルギーや電子親和力の結果と整合性があります。
電気陰性度が小さく電子対を引きつける力が弱いのが周期表の左下の元素ですが、電子を失って陽イオンになりやすい元素が周期表の左下にあることを考えると、納得できるでしょう。
同様に、電気陰性度が大きく電子対を引きつける力が強いのが周期表の右上の元素ですが、電子を受け取って陰イオンになりやすい元素は周期表の右側なので、矛盾のない結果です。
極性
原子ごとに電気陰性度の値は違います。そのため、共有結合している 2 つの原子の電気陰性度に差があると、共有電子対は電気陰性度の大きい原子に偏ります。
共有電子対が一方の原子に引き寄せられ、共有結合に電荷の偏りがあるとき、極性があるといいます。
同じ原子同士で共有結合をつくっているときは、電気陰性度に差はないので極性はありません。
塩化水素 HCl の分子には、水素原子と塩素原子の間に共有結合があります。塩素原子は水素原子より電気陰性度が大きいので、塩素原子側に共有電子対は偏ります。
塩素原子は共有電子対が近くなるので、少し負の電荷を帯びます。これを δ- (デルタマイナス)と表示します。
水素原子は共有電子対が遠くなり、少し正の電荷を帯びます。これを δ+ (デルタプラス)と表します。

水素 H2 分子は、水素原子同士で共有結合をつくっています。同じ原子なので電気陰性度に差はなく、共有結合に極性はありません。
極性分子と無極性分子
塩化水素は、共有結合に極性があり、分子全体として電荷に偏りがあります。このような極性がある分子のことを、極性分子といいます。
水素分子の結合に極性はなく、分子全体で電荷の偏りはありません。このような極性のない分子を、無極性分子といいます。
分子の形と極性
二原子分子では共有結合はひとつしかないので、2 つの原子の電気陰性度を比べれば、分子に極性があるかないかわかります。
しかし 3 つ以上の原子で構成される分子では、分子の形が極性に影響を与えます。
共有結合に極性があっても、分子全体でその極性が打ち消される場合、分子に極性はなくなり無極性分子となります。
分子内の結合に、強さは同じで向きが反対の極性があるとき、これらは互いに打ち消し合います。
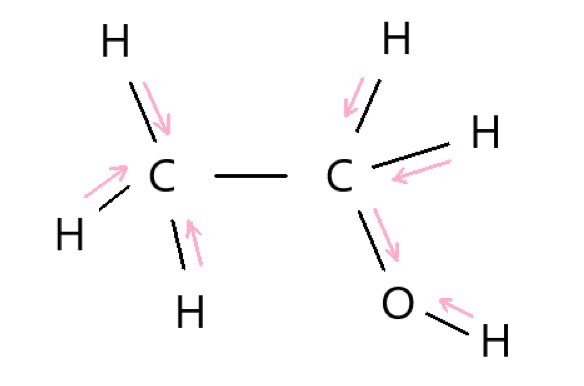
例えば、二酸化炭素 CO2 は無極性分子です。
炭素原子 C と酸素原子 O は二重結合で結びついています。酸素原子の方が電気陰性度が大きいので、共有電子対は酸素原子側に偏り、結合に極性があります。
しかし二酸化炭素は、炭素原子を中心にして、2 つの酸素原子が直線上の両端に並んでいます。2 つの二重結合では、どちらも共有電子対が酸素原子の方に引き寄せられています。
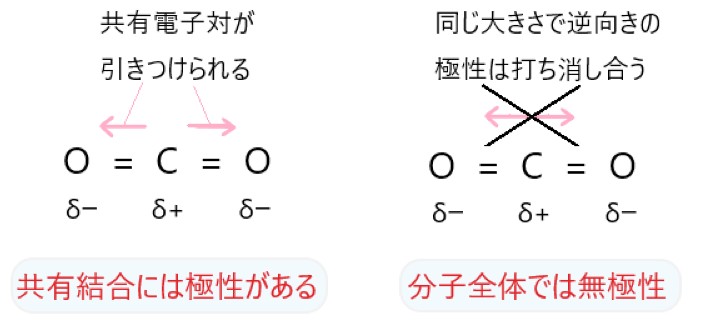
このとき極性の大きさは等しく、極性の向きは正反対なので、分子全体で見ると 2 つの極性は打ち消し合います。このため、二酸化炭素は極性がありません。
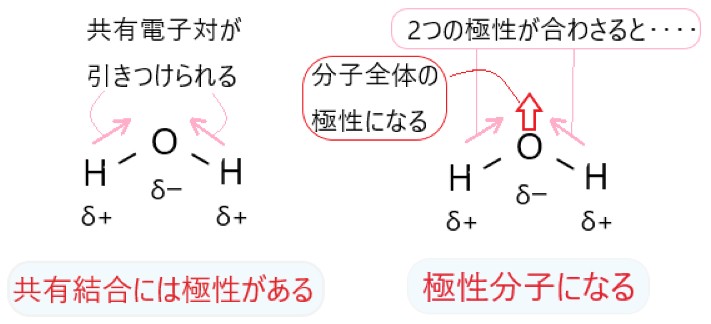
これに対して水 H2O 分子は、酸素原子を中心として折れ線形になっています。水素原子と酸素原子の共有結合では、酸素原子側に共有電子対が偏っています。
このとき分子内の 2 つの共有結合の極性は、打ち消し合う向きになっていません。この 2 つの極性が合わさるように、分子全体の極性が現れます。したがって水 H2O は極性分子です。
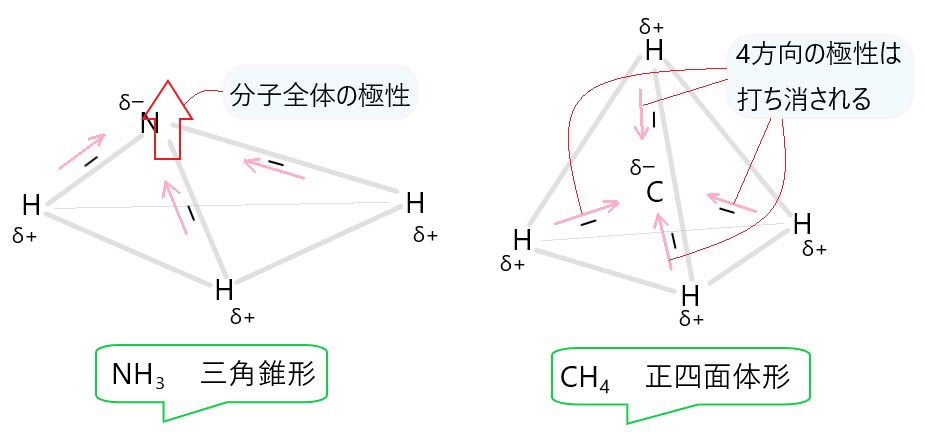
このほか、代表的な極性分子としてアンモニア NH3 、無極性分子としてメタン CH4 があります。
アンモニアの分子の形は、三角錐形です。窒素原子と水素原子の共有結合には極性があり、分子全体としても極性をもちます。
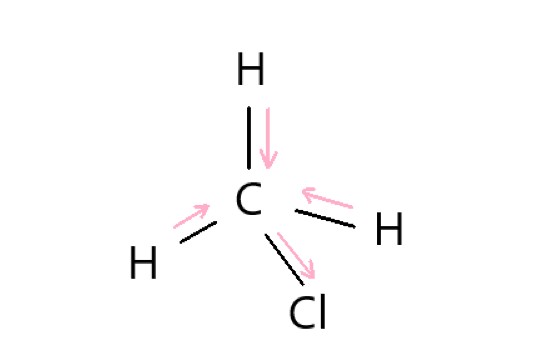
メタンの分子の形は、正四面体形です。炭素原子と水素原子の共有結合には極性があります。
しかし、この 4 つの共有結合は正四面体の頂点方向を向いています。それぞれの極性の大きさは等しく、4つの極性の向きは逆向きなので、全体として極性は打ち消されます。
そのためメタンは無極性です。
問題演習
確認テスト1
次の分子に極性が有るか無いか、考えてみましょう。
- 水素 H2
- 塩素 Cl2
- 臭素 Br2
- フッ化水素 HF
- 二酸化炭素 CO2
- 水 H2O
- アンモニア NH3
- メタン CH4
実践問題1(2019本第1問問5)
元素および原子の性質に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① イオン化エネルギーが大きい原子ほど、陽イオンになりやすい。
② 周期表の第 2 周期の元素の電気陰性度は、希(貴)ガスを除き、右側のものほど大きい。
③ ハロゲンの原子は、1 価の陰イオンになりやすい。
④ 遷移元素では、周期表で左右に隣り合う元素どうしの化学的性質が似ていることが多い。
(2019年度センター試験 本試験 化学基礎 第1問問5 より引用)
実践問題2(2015追第1問問5)
炭素原子と他の原子との単結合の極性が最も大きいものを、電気陰性度の差を考えて、次の①~⑤のうちから一つ選べ。
① C-N ② C-O ③ C-F
④ C-Cl ⑤ C-Br
(2015年度センター試験 追試験 化学基礎 第1問問5 より引用)
実践問題3(2020本第1問問3)
分子全体として極性がない分子を、次の①~⑤のうちから二つ選べ。ただし、解答の順序は問わない。
① 水 H2O ② 二酸化炭素 CO2 ③ アンモニア NH3
④ エタノール C2H5OH ⑤ メタン CH4
(2020年度センター試験 本試験 化学基礎 第1問問3 より引用)
実践問題4(2017追第1問問4)
次の分子ア~カには、下の記述( a ・ b )に当てはまる分子がそれぞれ二つずつある。その分子の組合せとして最も適当なものを、下の①~⑧のうちから一つずつ選べ。
ア CO2 イ Cl2 ウ NH3
エ H2 オ H2O カ CH4
a 分子内の結合に極性がなく、分子全体としても極性がない。
b 分子内の結合には極性があるが、分子全体としては極性がない。
① アとオ ② アとカ ③ イとウ ④ イとエ
⑤ ウとエ ⑥ ウとオ ⑦ エとオ ⑧ オとカ
(2017年度センター試験 追試験 化学基礎 第1問問4 より引用)
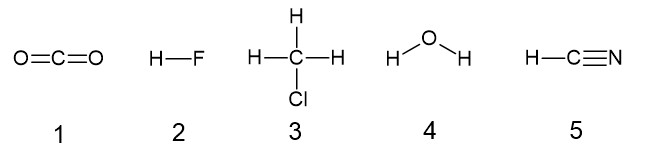
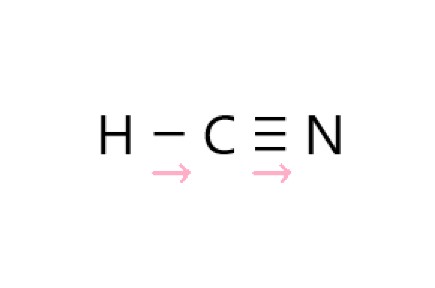
実践問題5(2015本第1問問5)
無極性分子であるものを、次の①~⑤のうちから一つ選べ。
① CO2 ② HF ③ CH3Cl
④ H2O ⑤ HCN
(2015年度センター試験 本試験 化学基礎 第1問問5 より引用)