分子やイオンを構成している原子が、もっている非共有電子対を、他の陽イオンに提供してできた結合を配位結合といいます。
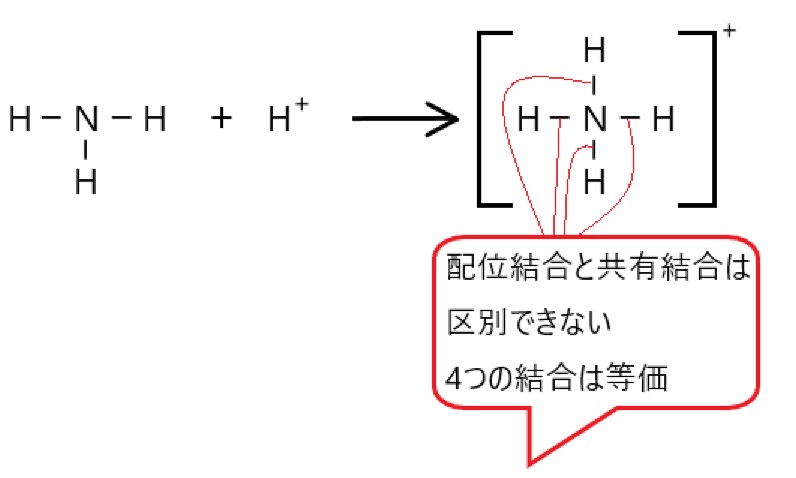
アンモニア NH3 が水素イオン H+ に非共有電子対を提供して、配位結合ができると、アンモニウムイオン NH4+ となります。
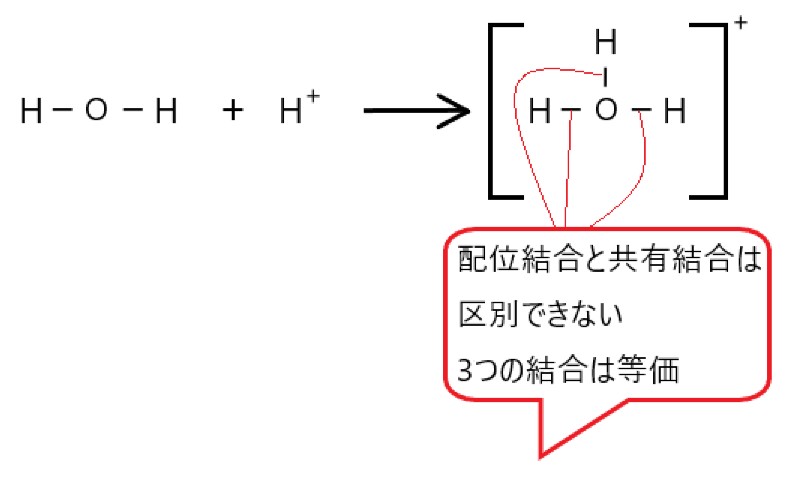
水 H2O が水素イオン H+ に非共有電子対を提供して、配位結合ができると、オキソニウムイオン H3O+ となります。
非共有電子対をもつ分子やイオンが金属イオンと配位結合してできたイオンを、錯イオンといいます。
もくじ
配位結合
2 つの原子が 1 個ずつ不対電子を出し合って、共有結合はできています。これに対し、1 つの原子が 2 個の電子を出してできる結合があります。
分子やイオンを構成している原子が、もっている非共有電子対を、他の陽イオンに提供してできた結合を配位結合といいます。
配位結合の例
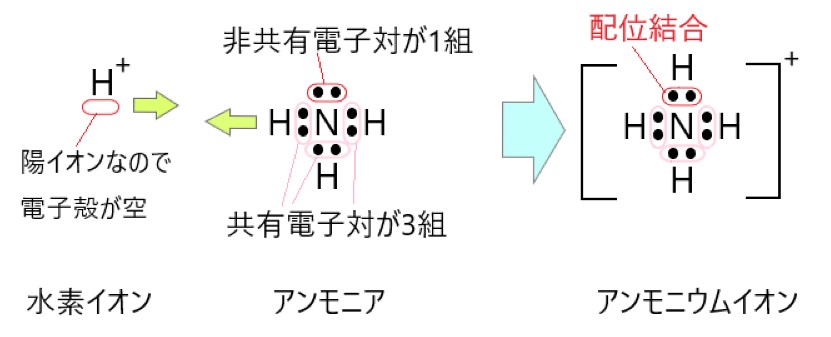
アンモニア分子 NH3 は、窒素原子が 3 つの共有電子対と 1 つの非共有電子対をもっています。ここで水素イオン H+ に非共有電子対を提供すると、配位結合ができます。
水素イオンは電子を放出して陽イオンとなっているので、電子殻に空きがあります。この空いている電子殻に、窒素原子が結合に使っていない 2 個の電子を提供することができます。
配位結合では、一方的に(窒素原子から水素イオンへ)電子対の電子が共有されます。また、こうしてできた陽イオンを、アンモニウムイオンといいます。
1 価の陽イオンの水素イオンと、電気的に中性なアンモニア分子が配位結合すると、1 価の陽イオンのアンモニウムイオンになります。
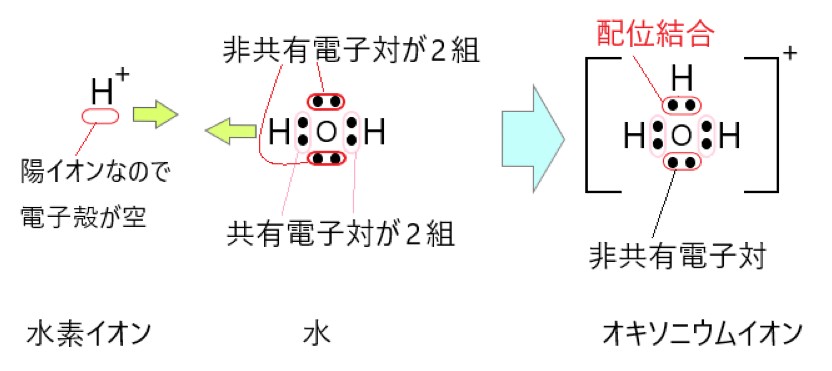
水分子 H2O は、酸素原子が 2 つの共有電子対と 2 つの非共有電子対をもっています。ここで水素イオン H+ に非共有電子対を提供すると、配位結合ができます。
電子を放出して空いた水素イオンの電子殻に、結合に使っていない酸素原子の 2 個の電子を提供します。この配位結合でできた陽イオンを、オキソニウムイオンといいます。
ところで、オキソニウムイオンでは、酸素原子と水素原子の間で 3 つの結合があります。
もともとは 2 つの共有結合と 1 つの配位結合でしたが、いちど配位結合ができてしまうと、これらの結合は区別できなくなります。
非共有電子対が提供されて配位結合が完成すると、この結合は(原子間に 2 個の電子を共有するという)共有結合の形になります。
そのため、もともとあった共有結合と、あたらしくできた配位結合では、違いがなくなります。
最終的にオキソニウムイオンでは、違いのない 3 つの共有結合があることになります。(いちおう、そのうちのどれか 1 つの結合は配位結合です。)
アンモニウムイオンでも同様で、3 つの共有結合と 1 つの配位結合をもちますが、これら 4 つの結合はすべて等価です。(見分けのつかない 4 つの共有結合になっています。)
なお構造式において、配位結合を矢印で表すことがあります。非共有電子対を提供する原子から、電子対を受け取る陽イオンの方向へ、矢印を伸ばします。

錯イオン
分子やイオンを構成している原子が、そのもっている非共有電子対を金属イオンに提供し、配位結合することがあります。
このとき金属イオンを中心にして、配位結合している複数の分子やイオンがまわりに配置されます。
このように複数の分子やイオンが配位結合して、金属イオンを取り囲んでできている物質のことを錯イオンといいます。
またこのとき、金属イオンに配位結合している分子やイオンのことを、配位子といいます。
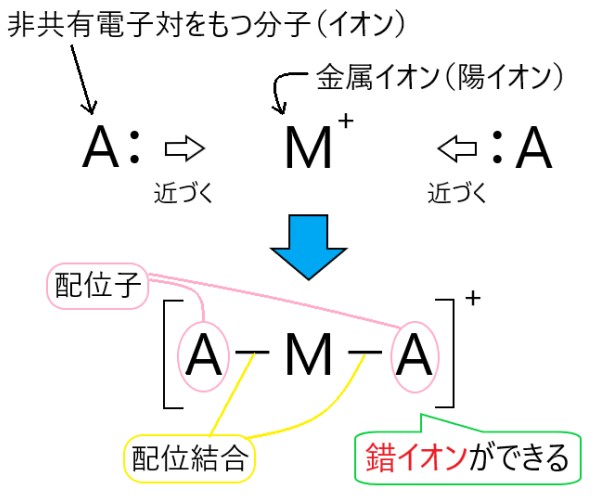
上の図では、金属イオン M+ に2つの配位子 A が配位結合して、[ M A2 ]+ という錯イオンができています。
ただし上の図のように、配位子の数が 2 つだったり、金属イオンと配位子が直線上に並んで錯イオンとなるとは限りません。金属イオンの種類によって、配位子の数や錯イオンの形は異なります。
例として、銅イオン Cu2+ と 4 つのアンモニア NH3 分子が配位結合してできる錯イオンをあげます。
この錯イオンは配位子が 4 つで、正方形の構造をとります。錯イオン全体で 2 価の陽イオンになります。

問題演習
確認テスト1
次の文章中の空欄に、適切な数字や語句を入れましょう。
アンモニア NH3 は、( A )つの共有電子対と( B )つの非共有電子対をもつ分子です。アンモニアの近くに水素イオン H+ があったとき、これに( C )の電子を提供してできる結合を( D )といいます。
( D )によりできたイオンは NH4+ で、これはアンモニウムイオンと呼ばれます。アンモニウムイオンには窒素原子と水素原子の間に、3つの共有結合と1つの( D )がありますが、これらの 4 つの結合は区別( E できます・できません )。
同様に、水 H2O が水素イオンと配位結合すると H3O+ が生じますが、これは( F )と呼ばれます。
非共有電子対をもつ分子やイオンが金属イオンと配位結合してできたイオンを、( G )といいます。
実践問題1(2019本第1問問6)
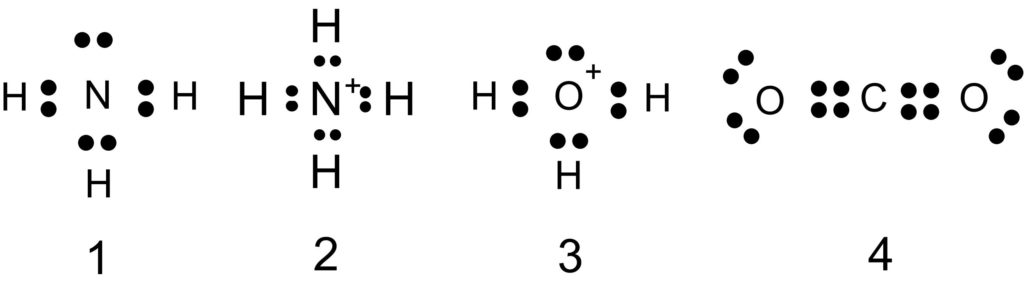
分子およびイオンに含まれる電子対に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① アンモニア分子は、3 組の共有電子対と 1 組の非共有電子対をもつ。
② アンモニウムイオンは、4 組の共有電子対をもつ。
③ オキソニウムイオンは、2 組の共有電子対と 2 組の非共有電子対をもつ。
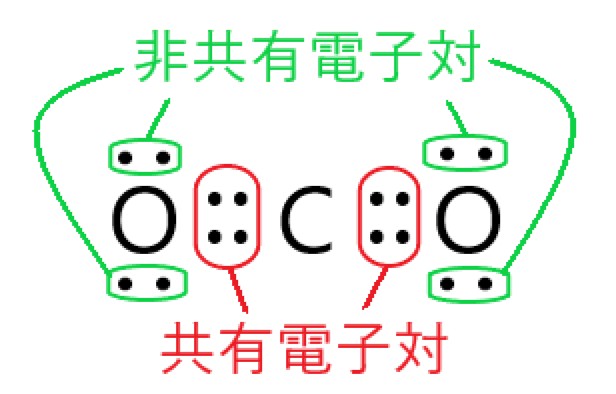
④ 二酸化炭素分子は、4 組の共有電子対と 4 組の非共有電子対をもつ。
(2019年度センター試験 本試験 化学基礎 第1問問6 より引用)