多数の原子が規則正しく共有結合でつながって並んだ固体を、共有結合の結晶といいます。
共有結合の結晶は、組成式で表されます。
共有結合の結晶には、ダイヤモンドや黒鉛、ケイ素や水晶などがあります。
共有結合の結晶は一般に、硬くて融点が高く、電気を通しません。
例外的に黒鉛(グラファイト)は柔らかく、薄くはがれやすい構造で、電気を通します。
もくじ
共有結合の結晶
多数の原子が規則正しく共有結合でつながって並んだ固体を、共有結合の結晶(共有結合結晶)といいます。
共有結合の結晶は、共有結合がどこまでもつながっているので、結晶をつくっている原子の存在比である組成式で表されます。
共有結合の結晶には、ダイヤモンドや黒鉛(グラファイト)、ケイ素や水晶などがあります。
このうち、ダイヤモンドと黒鉛は炭素原子 C からできています。ケイ素はケイ素原子 Si から、水晶は二酸化ケイ素 SiO2 からできています。
共有結合結晶の性質
共有結合の結晶は一般に、硬くて融点が高いです。これは共有結合が強力なので、結晶をつくっている原子同士がしっかりと結ばれており、簡単には動かないためです。
そのため、共有結合結晶は非常に硬いものが多く、また融点も高くなります。
また共有結合結晶は、電気を通しません。これは結晶をつくっている原子の電子が、すべて共有結合のために使われており、自由に動ける電子が余っていないためです。
ただし例外的に黒鉛は柔らかく、薄くはがれやすい構造で、電気を通します。
ダイヤモンド
ダイヤモンドは、炭素原子の 4 つの価電子がまわりの炭素原子と共有結合し、正四面体形の構造を繰り返してできています。
これは前の項目の分子の形で学んだように、炭素原子がもつ 4 つの共有電子対が負電荷の反発を避けるため、正四面体の頂点の方向に向くためです。
そのため、すべての炭素原子が正四面体形の頂点の方向に共有結合を向けるため、立体網目状の結晶となります。

ダイヤモンドの共有結合はとても強いので、ダイヤモンドは非常に硬く、融点も極めて高いです。結晶は無色透明で、電気を通しません。
黒鉛(グラファイト)
黒鉛は炭素原子同士が共有結合でつながった結晶ですが、ダイヤモンドと構造が異なります。
炭素原子は、まわりの 3 個の炭素原子と共有電子対をもちます。黒鉛の炭素原子は、3 つの共有結合をもつ状態です。
分子の形の項で学んだように、原子のまわりに 3 つの電子対があると、負電荷の反発を避けるため、それぞれの電子対が 120 度ずつの角度で離れます。
黒鉛の炭素原子は 120 度ずつ共有結合の方向をとるので、黒鉛は平面上に正六角形を繰り返し配置したような構造となります。
黒鉛は、この正六角形で繰り返された、炭素原子でできた層状の化合物が積み重なったものです。

ところで、炭素原子のもつ不対電子は 4 個です。通常は他の原子の 4 つの不対電子を受け取り、4 つの共有電子対をつくります。
しかし黒鉛では、炭素原子のまわりの 3 方向に共有結合ができています。黒鉛の炭素原子では、不対電子が 1 個残ります、
この共有結合に参加せず余っている不対電子は、炭素原子の真上か真下あたりに存在しています。
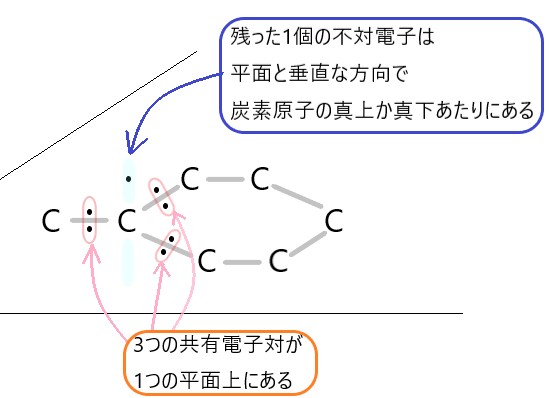
結果として黒鉛の構造は、炭素原子が 3 つの共有結合で平面的につながってできた層が、重なってできています。
その層と層のあいだには、それぞれの炭素原子の不対電子が1個ずつ広がっています。不対電子の広がりがあるので、黒鉛は電気が流れます。
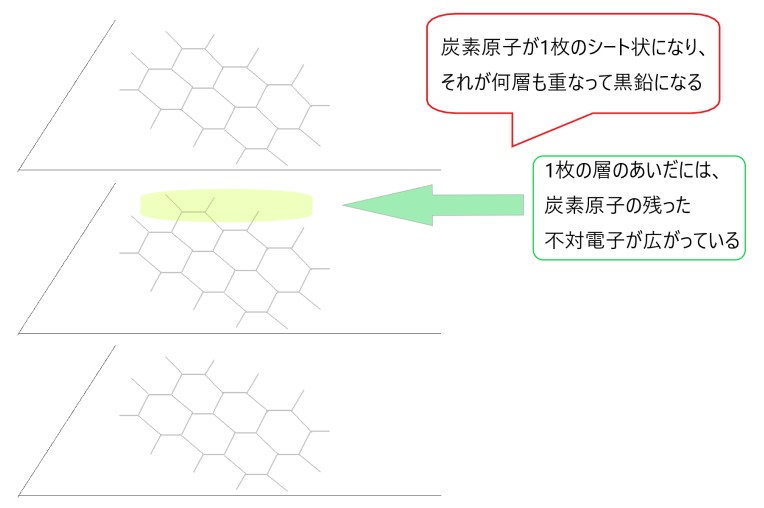
こうして黒鉛は、柔らかくてはがれやすく、電気を通す性質をもちます。
ケイ素
ケイ素 Si は炭素と同じ 14 族の元素です。ケイ素の価電子の数は 4 個なので、ケイ素原子は 4 つの共有結合をつくります。
ケイ素の共有結合結晶は、ダイヤモンドと同じように正四面体形の構造を繰り返してできています。
二酸化ケイ素(石英・水晶)
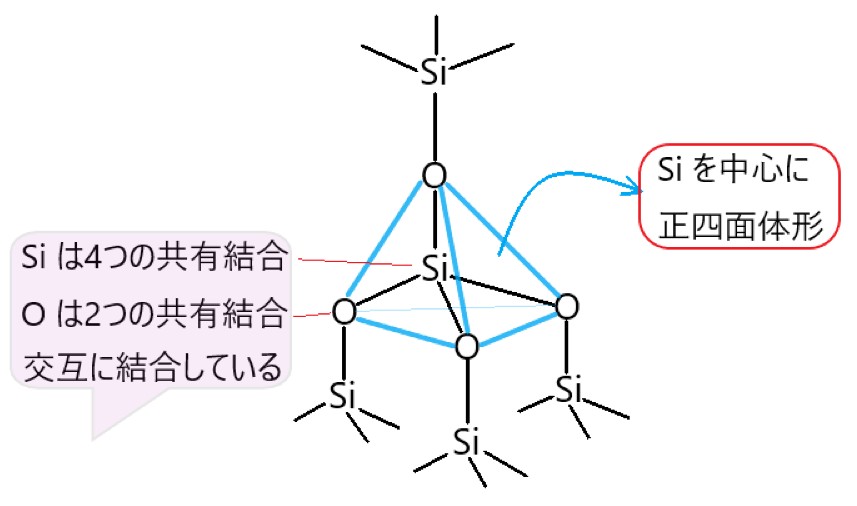
二酸化ケイ素 SiO2 の共有結合の結晶が、石英や水晶です。
ケイ素 Si 原子の価電子の数は 4 個なので、4 つの共有結合をつくります。酸素原子の価電子の数は 6 個で不対電子が 2 個あるので、2つの共有結合をつくります。
そのため二酸化ケイ素の結晶は、ケイ素原子が正四面体の中心にあり、その 4 つの頂点に酸素原子がある形で共有結合しています。
問題演習
確認テスト1
次の文章中の空欄に、適切な語句を埋めましょう。
共有結合の結晶とは、多くの原子が規則正しく共有結合によりつながってできた固体です。炭素原子の共有結合結晶には、( A )や( B )があります。
( A )と( B )は同じ元素の単体ですが、違う性質をもつので( C )と呼ばれます。( A )は、炭素原子がまわりの 4 つの炭素原子と共有結合し、正四面体形の構造をもっています。
( A )などの共有結合の結晶は、一般に( D 硬く・柔らかく )、融点は( E 高い・低い )です。また、電気を( F 通します・通しません )。これは結晶のなかの原子同士が、共有結合で強く結びついているためです。
例外的に( B )は、( G 硬く・柔らかく )てはがれやすい性質があります。また電気を( H 通します・通しません )。
実践問題1(2018本第1問問1)
『共有結合の結晶であるものの組合せ』に当てはまるものとして最も適当なものを、次の①~⑤のうちから一つ選べ。
① ダイヤモンドとケイ素
② ドライアイスとヨウ素
③ 塩化アンモニウムと氷
④ 銅とアルミニウム
⑤ 酸化カルシウムと硫酸カルシウム
(2018年センター試験 本試験 化学基礎 第1問問1 より一部を引用)
