ポイント
原子核の周りには電子が存在できる空間の層があり、これを電子殻といいます。
電子殻は原子核に近い内側から、K 殻、L 殻、M 殻、N 殻‥‥といいます。
それぞれの電子殻には、収まる電子の数の上限が決まっています。K 殻は 2 個、L 殻は 8 個、M 殻は 18 個、N 殻は 32 個です。
原子核から n 番目の電子殻には、最大 2n2 個の電子が入ります。
どの電子殻に何個の電子が収容されているかを、原子の電子配置といいます。電子は内側の電子殻から収容されます。
最も外側の電子殻のことを最外殻といい、最外殻にあって反応などに関与する電子を価電子といいます。
価電子は、最外殻にある電子の数と一致します。ただし希ガスは価電子を 0 とします。
電子配置
原子の構造を簡単に考えると、原子の中心に原子核があって、その周りを電子が動いています。
このとき、電子が存在できる空間はいくつかの層に分かれています。この層のことを電子殻といいます。

それぞれの電子殻に電子が何個入っているのかを、その原子の電子配置といいます。
電子殻
原子核の周りには、電子が存在できるいくつかの空間の層があります。この層のことを電子殻といいます。
電子殻は原子核から近い順に、K 殻、L 殻、M 殻、N 殻‥‥といいます。
またそれぞれの電子殻には、入ることができる電子の数に上限があります。入れられる電子の最大数は K 殻で 2 個、L 殻で 8 個、M 殻で 18 個、N 殻で 32 個と決まっています。

電子殻に入る電子の最大数には、規則性があります。原子核から n 番目の電子殻に収容できる電子数は、2n2 個と表すことができます。
K 殻は原子核から 1 番目の電子殻なので、2 × 12 = 2 となり、最大で 2 個の電子が入ります。同様に L 殻は 2 番目の電子殻なので、2 × 22 = 8 のように最大 8 個の電子が入ります。
電子配置のルール
原子内の電子は、一般に内側の電子殻から順に入っていきます。これは原子核に近い電子殻に入ると、エネルギーが低い状態となって安定になるためです。
例えば、原子番号 6 の炭素原子 C は電子が 6 個あるので、まず K 殻に 2 個の電子が入り、そのあと L 殻に 4 個の電子が入ります。

原子番号 11 のナトリウム原子 Na では電子が 11 個あるので、まず K 殻に 2 個の電子が入り、そのあと L 殻に 8 個の電子が入り、M 殻に残りの 1 個の電子が入ります。

原子内の電子殻に電子が収容された状態を電子配置といいますが、各原子の電子配置はルールに従って決まります。
また、原子の最も外側にある電子殻のことを最外殻といい、最外殻に入っている電子のことを最外殻電子といいます。
価電子
この最も外側の電子殻にあり、反応や結合に関与する電子のことを、特に価電子と呼んでいます。
原子の最も外側にある電子は、他の原子と結合したり反応するときに大きな役割をするので、価電子(最外殻電子)は重要です。
価電子は、0 個から 7 個のあいだの数をとります。一般に、最外殻の電子数と価電子の数は一致します。
例えば、ナトリウム原子は一番外側の電子殻( M 殻)に 1 個の電子をもつので、価電子は 1 個です。
炭素原子は一番外側の電子殻( L 殻)に 4 個の電子をもつので、炭素原子の価電子の数は 4 個です。
ただし、ヘリウム He やネオン Ne 、アルゴン Ar など希ガスといわれる元素の原子は、価電子を 0 とします。希ガスの原子はとても安定なので、他の原子と結合しにくいことを考慮して価電子は 0 です。
間違いやすいのは、希ガスの原子の最外殻の電子の数は 0 ではないということです。
例えば、ヘリウム He は原子番号が 2 なので電子が 2 個あり、K 殻に 2 個の電子が入っています。He は希ガスなので価電子の数は 0 個ですが、最外殻の電子の数は 2 個です。
ネオン Ne は原子番号が 10 なので電子が 10 個あり、K 殻に 2 個、L 殻に 8 個の電子が入っています。Ne は希ガスなので価電子の数は 0 個ですが、最外殻電子数は 8 個です。
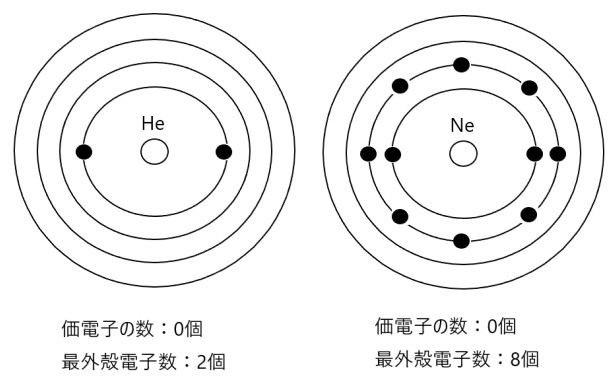
まとめると、原子の最外殻電子数と価電子の数は(希ガス以外では)一致します。
希ガスの価電子の数は常に 0 個です。希ガスの原子のうち、ヘリウム He の最外殻電子数は 2 個、その他の希ガスの原子であるネオン Ne 、アルゴン Ar 、クリプトン Kr などの最外殻電子数は 8 個です。
なお、ヘリウムやネオンのように電子殻が電子で満たされているとき、この状態を閉殻といいます。
問題演習
確認テスト1
( )に入る適切な語句を考えてみましょう。
原子内の電子は、原子核の周りにある( A )という層に収容されます。( A )は何層にも分かれており、原子核に近い順に( B )、L 殻、( C )、N 殻‥‥と呼ばれます。
それぞれの( A )に入る電子の最大数は決まっていて、( B )は( D )個です。また、L 殻に入る電子数は最大で 8 個、( C )に入る電子数は最大で( E )個です。
このように、( A )に入る電子の最大数には規則性があり、内側からn番目の( A )には( F )個の電子が入ります。
どの( A )に何個の電子が収容されているかを、原子の( G )といいます。
原子が他の原子と結合するとき、最も外側の電子殻にある電子が大きな役割を果たします。そこで、最外殻の電子を特に( H )といいます。一般に( H )の数は最外殻の電子数と同じですが、希ガスの原子では( H )の数は( I )個となります。
正解を見る
A:電子殻 B:K 殻 C:M 殻 D:2 E:18
F:2n2 G:電子配置 H:価電子 I:0
確認テスト2
原子内の電子がどのように配置されているか、次の表の空欄を埋めましょう。
| 原子 | 原子番号 | K殻 | L殻 | M殻 | N殻 |
| 水素 H | 1 | 1 | | | |
| ヘリウム He | 2 | | | | |
| ホウ素 B | 5 | | 3 | | |
| 窒素 N | 7 | | | | |
| フッ素 F | 9 | | | | |
| マグネシウム Mg | 12 | | 8 | | |
| ケイ素 Si | 14 | 2 | | | |
| 硫黄 S | 16 | | | | |
| アルゴン Ar | 18 | 2 | 8 | | |
| カリウム K | 19 | | | | |
正解を見る
| 原子 | 原子番号 | K殻 | L殻 | M殻 | N殻 |
| 水素 H | 1 | 1 | | | |
| ヘリウム He | 2 | 2 | | | |
| ホウ素 B | 5 | 2 | 3 | | |
| 窒素 N | 7 | 2 | 5 | | |
| フッ素 F | 9 | 2 | 7 | | |
| マグネシウム Mg | 12 | 2 | 8 | 2 | |
| ケイ素 Si | 14 | 2 | 8 | 4 | |
| 硫黄 S | 16 | 2 | 8 | 6 | |
| アルゴン Ar | 18 | 2 | 8 | 8 | |
| カリウム K | 19 | 2 | 8 | 8 | 1 |
原子番号 18 のアルゴン Ar までは、内側の電子殻から順に電子が入っていきます。
カリウム K 原子では違いがあります。カリウムの原子番号は 19 で、原子内に電子は 19 個あります。
K 殻と L 殻には閉殻となるまで電子が入ります。次の M 殻は 8 個の電子が入ったあと、まだ M 殻に 10 個の電子が入りますが、先に N 殻へ電子が入ります。
これは M 殻に電子が 8 個入ったあと N 殻に電子が続けて入った方が、原子が安定な状態になるためです。
原子番号 20 のカルシウム Ca も同様に、M 殻に 8 個の電子が入ったら、次に N 殻に 2 個の電子が入ります。
(したがってカルシウムの電子配置は、K 殻に 2 個、L 殻に 8 個、M 殻に 8 個、N 殻に 2 個の電子となります。)
確認テスト3
次の原子の最外殻電子数と価電子の数を答えましょう。
- He
- N
- Mg
- S
- Ar
- K
正解を見る
- 最外殻電子:2 個 価電子:0 個
- 最外殻電子:5 個 価電子:5 個
- 最外殻電子:2 個 価電子:2 個
- 最外殻電子:6 個 価電子:6 個
- 最外殻電子:8 個 価電子:0 個
- 最外殻電子:1 個 価電子:1 個
実践問題1(2019本第1問問1)
次のように表される原子 A に関する記述として誤りを含むものを、下の①~④のうちから一つ選べ。

① 最外殻には、7 個の電子が存在する。
② 原子核には、9 個の陽子が含まれる。
③ 原子核には、9 個の中性子が含まれる。
④ 質量数は、19 である。
(2019年度センター試験 本試験 化学基礎 第1問問1 より引用)
正解を見る
正解 3
この問題は、元素が A である原子 A の例です。元素記号 A の左上と左下に数字が書かれています。
左下の数字は原子番号で、左上の数字は質量数です。
原子番号は、その原子がもつ陽子の数と一致します。また質量数は、その原子の陽子の数と中性子の数の和です。
したがって原子 A は、原子番号 9(つまり陽子数が 9 個)の原子です。
原子がもつ陽子の数と電子の数は等しいので、原子 A がもつ電子の数も 9 個です。
質量数は 19 なので、中性子の数は
質量数 = 陽子の数 + 中性子の数
ですから
19 = 9 + 中性子の数
となり、中性子の数は 10 個です。
1 〇 電子が 9 個ある原子では、まず一番内側の殻( K 殻)に 2 個の電子が入ります。そのあと、7 個の電子がその外側の L 殻に入ります。したがって、最外殻の電子数は 7 個です。
2 〇 原子番号が 9 なので、陽子の数は 9 個です。
3 × 質量数は陽子の数と中性子の数の和です。中性子の数は正しくは 10 個です。
4 〇 元素記号の左上に書かれた数字は、質量数です。
実践問題2(2018本第1問問2)
ホウ素原子の電子配置の模式図として最も適当なものを、次の①~⑥のうちから一つ選べ。

(2018年度センター試験 本試験 化学基礎 第1問問2 より引用)
正解を見る
正解 3
ホウ素原子は原子番号が 5 の原子です。
原子番号が 5 なので、陽子の数が 5 個となり、原子核にある正の電荷は 5+ になります。
また原子がもつ陽子と電子の数は等しいので、ホウ素原子の電子は 5 個になります。
電子が 5 個あるので、内側の電子殻から電子は収容されます。
K 殻に入る電子の最大数は 2 個なので、電子は一番内側にある K 殻に 2 個入ります。そして、その外側の L 殻に 3 個入ります。
以上より、最も適当な選択肢は③です。
実践問題3(2018追第1問問3)
原子番号と価電子の数の関係を表すグラフとして正しいものを、次の①~⑤のうちから一つ選べ。



(2018年度センター試験 追試験 化学基礎 第1問問3 より引用)
正解を見る
正解 4
原子番号が増えていくとき、価電子はどう変化するのかという問題です。
まずはじめに、原子番号とその原子がもつ陽子の数は等しいことを思い出します。また、原子がもつ陽子の数と電子の数は等しいことを考えます。
つまり原子がもつ電子が 1 個ずつ増えていくと、価電子はどうなるのかを調べます。
価電子は、最外殻の電子数と一致します。ただし、希ガス元素のときは価電子は 0 です。
そこで、原子番号が増えて原子のもつ電子数が増加していくと、その電子配置はどうなるのか(最外殻の電子数はいくつか)を考えれば、この問題を解けます。
グラフは原子番号 20 までなので、原子番号 1 の水素原子から、原子番号 20 のカルシウム原子までの電子配置を考えます。
そしてそれぞれの価電子を決めれば、正しいグラフを選ぶことができます。
以下は原子番号 1 の水素原子から原子番号 20 のカルシウム原子までの電子配置の表です。
| 原子 | 原子番号 | K殻 | L殻 | M殻 | N殻 | 価電子 |
| 水素 H | 1 | 1 | | | | 1 |
| ヘリウム He | 2 | 2 | | | | 0 |
| リチウム Li | 3 | 2 | 1 | | | 1 |
| ベリリウム Be | 4 | 2 | 2 | | | 2 |
| ホウ素 B | 5 | 2 | 3 | | | 3 |
| 炭素 C | 6 | 2 | 4 | | | 4 |
| 窒素 N | 7 | 2 | 5 | | | 5 |
| 酸素 O | 8 | 2 | 6 | | | 6 |
| フッ素 F | 9 | 2 | 7 | | | 7 |
| ネオン Ne | 10 | 2 | 8 | | | 0 |
| ナトリウム Na | 11 | 2 | 8 | 1 | | 1 |
| マグネシウム Mg | 12 | 2 | 8 | 2 | | 2 |
| アルミニウム Al | 13 | 2 | 8 | 3 | | 3 |
| ケイ素 Si | 14 | 2 | 8 | 4 | | 4 |
| リン P | 15 | 2 | 8 | 5 | | 5 |
| 硫黄 S | 16 | 2 | 8 | 6 | | 6 |
| 塩素 Cl | 17 | 2 | 8 | 7 | | 7 |
| アルゴン Ar | 18 | 2 | 8 | 8 | | 0 |
| カリウム K | 19 | 2 | 8 | 8 | 1 | 1 |
| カルシウム Ca | 20 | 2 | 8 | 8 | 2 | 2 |
原子番号 1 の H は K 殻に電子が 1 個入り、最外殻電子数が 1 なので価電子は 1 となります。
原子番号 2 の He は K 殻に電子が 2 個入り、K 殻が電子で埋まり閉殻となります。He は希ガスと呼ばれる元素なので、価電子は 0 となります。
原子番号 3 の Li から原子番号 10 の Ne までは、電子は L 殻に入ります。
原子番号 3 の Li は K 殻に電子が 2 個入り、次の電子は L 殻に 1 個入ります。最外殻電子は L 殻の 1 個なので、価電子は 1 となります。
同様に原子番号 4 の Be は K 殻に電子が 2 個入り、次の電子は L 殻に 2 個入ります。最外殻電子は L 殻の 2 個なので、価電子は 2 となります。
原子番号 9 の F までは、同じように価電子が 1 ずつ増えていきます。
原子番号 10 の Ne は、K 殻に電子が 2 個入り、次の電子は L 殻に 8 個入ります。最外殻電子は L 殻の 8 個で、L 殻はすべて埋まり閉殻となります。
Ne は希ガスと呼ばれる元素で、L 殻に電子が 8 個入り閉殻なので、価電子は 0 です。
原子番号 11 の Na から原子番号 18 の Ar までは、電子は M 殻に入ります。
原子番号 11 の Na は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 1 個入ります。最外殻電子は M 殻の 1 個なので、価電子は 1 となります。
同様に原子番号 12 の Mg は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 2 個入ります。最外殻電子は M 殻の 2 個なので、価電子は 2 となります。
原子番号 17 の Cl までは、同じように価電子が 1 ずつ増えていきます。
原子番号 18 の Ar は、K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 8 個入ります。最外殻電子は M 殻の 8 個です。
最外殻の電子数が 8 個になると、原子は安定します。Ar は希ガスと呼ばれる元素で、M 殻に電子が 8 個入っているので、価電子は 0 です。
原子番号 19 の K から原子番号 20 の Ca までは、電子は N 殻に入ります。
原子番号 19 の K は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 8 個、さらに次の電子は N 殻に 1 個入ります。最外殻電子は N 殻の 1 個なので、価電子は 1 となります。
同様に原子番号 20 の Ca は K 殻に電子が 2 個入り、次の電子は L 殻に 8 個、さらに次の電子は M 殻に 8 個、さらに次の電子は N 殻に 2 個入ります。最外殻電子は N 殻の 2 個なので、価電子は 2 となります。
以上の結果をまとめると、正しいグラフは④となります。










