電荷を持った粒子をイオンといい、正の電荷を持った粒子を陽イオン、負の電荷を持った粒子を陰イオンといいます。
物質が水に溶けて、水溶液中で分離しイオンになることを、電離といいます。
水に溶けると電離してイオンになる物質を、電解質といいます。電解質が溶けた水溶液は電気を通します。
水に溶けてもイオンにならない物質を、非電解質といいます。非電解質は、水に溶けても電気を通しません。
原子が電子を失うと陽イオンになります。原子が電子を受け取ると陰イオンになります。
原子がイオンになるとき、安定な希ガスと同じ電子配置をとります。
原子がイオンになるときに出入りした電子の数を、イオンの価数といいます。
イオンを表すには、原子の元素記号の右上に、正負の記号を書きます。価数が 2 以上のときは価数も書きます。
原子 1 個からなるイオンを、単原子イオンといいます。
複数の原子でできた粒子がイオンになったものを、多原子イオンといいます。
もくじ
イオンとは
物質をつくっている原子は電気的に中性で、プラスの電荷もマイナスの電荷も持っていません。
原子の中心にある原子核には正の電荷を持つ陽子があり、外側の電子殻には負の電荷を持つ電子があります。しかし原子では、陽子の数と電子の数が等しいので、正と負の電荷は打ち消されます。
もし原子が外部から電子を受け取ったり、外部に電子を放出したりすると、原子内の陽子数と電子数がつり合わなくなります。
原子が外部に電子を放出すると、原子は正の電荷を持つ陽子の数が多くなるので、原子は正の電荷を持った粒子となります。
原子が外部から電子を受け取ると、原子は負の電荷を持つ電子の数が多くなるので、原子は負の電荷を持った粒子となります。
このような、正か負どちらかの電荷を帯びた粒子のことをイオンといいます。正の電荷を持つイオンを陽イオン、負の電荷を持つイオンを陰イオンといいます。
電解質と非電解質
水に物質を溶かしたとき、その水溶液が電気を通す場合と通さない場合があります。
水溶液が電気を通す場合、その水溶液のなかには、電荷を持った粒子であるイオンが存在しています。このイオンは、水に溶かした物質からできたものです。
水に溶かしたときに物質が水中で分かれてイオンになることを電離といい、このような物質を電解質といいます。
一方、電気を通さない水溶液は、そのなかにイオンが存在しません。物質を溶かしても水中でイオンにならないと、その水溶液は電気を通しません。
水に溶かしたときにイオンとならない物質を、非電解質といいます。
電解質の例として、食塩(塩化ナトリウム)があります。塩化ナトリウムを水に溶かすと、電離してイオンとなり、食塩水は電気を通します。
非電解質の例として、砂糖(ショ糖)があります。ショ糖を水に溶かしても、イオンにはならず、砂糖水は電気を通しません。
陽イオン
陽イオンとは、正の電荷を持った粒子です。電気的に中性な原子が電子を失うと、失った電子の数だけ正の電荷を帯びる陽イオンになります。
原子番号 11 のナトリウム原子は、原子核に陽子を 11 個、電子殻に電子を 11 個もち、電気的に中性です。
ナトリウム原子の電子配置は、K 殻に 2 個、L 殻に 8 個、M 殻に 1 個です。
このナトリウム原子から電子が 1 個失われると、陽イオンとなります。失われる電子は、最も外側にある M 殻からです。

原子が陽イオンになるときは、その原子に近い大きさの希ガス原子と同じ電子配置になります。これは希ガスが安定な原子であり、その安定な電子配置になるように電子が放出されるからです。
上のナトリウム原子の例では、原子番号 10 のネオンが希ガスで安定なので、その電子配置になるように電子が失われます。
M 殻から電子が 1 個失われると、K 殻に 2 個と L 殻に 8 個の電子配置となり、ネオン原子と同じになります。
このとき、ナトリウム原子は M 殻に電子が存在しなくなり、陽イオンであるナトリウムイオンの最外殻は L 殻になります。そのため、ナトリウム原子がナトリウムイオンになると、原子の大きさ(原子半径)が小さくなります。
陰イオン
陰イオンとは、負の電荷を持った粒子です。電気的に中性な原子が電子を受け取ると、受け取った電子の数だけ負の電荷を帯びる陰イオンになります。
原子番号 9 のフッ素原子は、原子核に陽子を 9 個、電子殻に電子を 9 個をもち、電気的に中性です。フッ素原子の電子配置は、K 殻に 2 個、L 殻に 7 個です。
このフッ素原子が外部から電子を 1 個受け取ると、陰イオンとなります。受け取った電子は、最も外側にある電子殻( L 殻)に入ります。
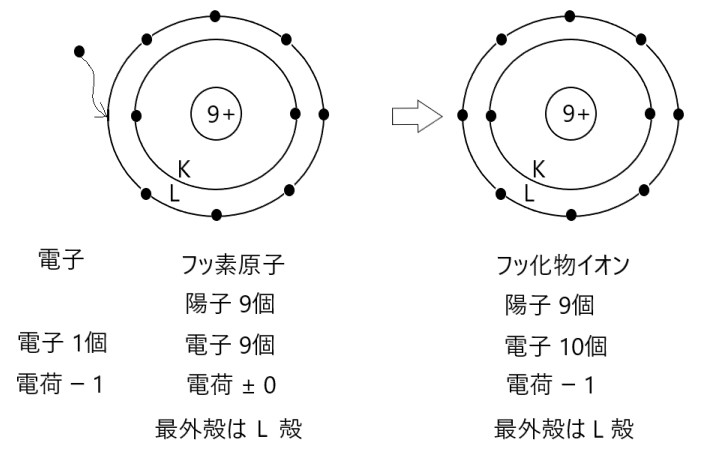
陰イオンになるときも、大きさの近い希ガス原子と同じ電子配置になります。原子番号 9 のフッ素原子に大きさの近い希ガスは、原子番号 10 のネオンです。
K 殻に 2 個、L 殻に 7 個の電子をもっていたフッ素原子は、外部から 1 個の電子を L 殻に受け取り、フッ化物イオンになります。
そしてフッ化物イオンは、希ガスのネオン原子と同じように K 殻に 2 個、L 殻に 8 個電子をもつ、安定な電子配置になります。
イオンの価数
粒子が受け取ったり失ったりする電子の数は、1 個に限りません。2 個以上の電子をやり取りすることがあります。このとき、粒子が受け取ったり放出したりした電子の数を、イオンの価数といいます。
ナトリウムイオンの例では、1 個の電子を放出しているので、1 価の陽イオンといいます。同様に、フッ化物イオンを 1 価の陰イオンといいます。
原子番号 20 のカルシウム原子の電子配置は、K 殻に 電子が 2 個、L 殻に 8 個、M 殻に 8 個、N 殻に 2 個となっています。
カルシウム原子に近い安定な希ガスは、原子番号 18 のアルゴンです。
カルシウム原子がイオンになるときは、アルゴン原子の電子配置になります。カルシウム原子は 2 個の電子を放出し、陽イオンになります。したがって、カルシウムイオンは 2 価の陽イオンです。

イオンの表し方
イオンを表現するには、原子の元素記号を書き、その右上に正か負の記号をつけます。これをイオン式といいます。
ナトリウムイオンのイオン式は Na+ 、フッ化物イオンのイオン式は F- となります。
イオンの価数が 1 より大きいときは、価数も右上に書きます。カルシウムイオンのイオン式は Ca2+ と書けます。
アルミニウムイオンは 3 価の陽イオンなので、アルミニウムイオンは Al3+ です。
単原子イオンと多原子イオン
これまでは原子がイオンになる例を見てきました。原子 1 個からなるイオンを、単原子イオンといいます。
ナトリウムイオン Na+ 、フッ化物イオン F-、カルシウムイオン Ca2+、アルミニウムイオン Al3+ などは単原子イオンです。
これに対し、複数の原子でできた粒子がイオンになったものを、多原子イオンといいます。
以下に多原子イオンの例をあげます。
| OH- | 1価の陰イオン | 水酸化物イオン |
| NH4+ | 1価の陽イオン | アンモニウムイオン |
| NO3- | 1価の陰イオン | 硝酸イオン |
| CO32- | 2価の陰イオン | 炭酸イオン |
| SO42- | 2価の陰イオン | 硫酸イオン |
| PO43- | 3価の陰イオン | リン酸イオン |
問題演習
確認テスト1
次の原子がイオンとなったときの電子配置を考えましょう。
- 水素 H
- リチウム Li
- フッ素 F
- ナトリウム Na
- マグネシウム Mg
- アルミニウム Al
- 硫黄 S
- 塩素 Cl
- カリウム K
確認テスト2
例にならって、次のイオンのイオン式を書き、何価のイオンか考えましょう。
例)水素イオン H+ 1価の陽イオン
| ナトリウムイオン | ||
| カルシウムイオン | ||
| マグネシウムイオン | ||
| アルミニウムイオン | ||
| フッ化物イオン | ||
| 塩化物イオン | ||
| 臭化物イオン | ||
| 硫化物イオン | ||
| 水酸化物イオン | ||
| アンモニウムイオン | ||
| 硝酸イオン | ||
| 炭酸イオン | ||
| 硫酸イオン | ||
| リン酸イオン |
実践問題1(2020本第1問問1)
原子およびイオンの電子配置に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 炭素原子 C の K 殻には、2 個の電子が入っている。
② 硫黄原子 S は、6 個の価電子をもつ。
③ ナトリウムイオン Na+ の電子配置は、フッ化物イオン F- の電子配置と同じである。
④ 窒素原子 N の最外殻電子の数は、リン原子 P の最外殻電子の数と異なる。
(2020年度センター試験 本試験 化学基礎 第1問問1 より引用)
実践問題2(2015追第1問問4)
ネオンと同じ電子配置をもつイオンを、次の①~⑤のうちから一つ選べ。
① Be2+ ② Mg2+ ③ K+
④ Cl- ⑤ S2-
(2015年度センター試験 追試験 化学基礎 第1問問4 より引用)
実践問題3(2019追第1問問2)
原子およびイオンに関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① 塩化物イオンの電子配置はアルゴン原子と同じである。
② ナトリウム原子が陽イオンになると、陽イオンの大きさはもとの原子よりも小さくなる。
③ 陽子の数が等しい原子は、中性子の数が異なっても化学的性質はほぼ同じである。
④ 陽子 1 個と中性子 1 個の質量は、ほぼ等しい。
⑤ 電子殻の L 殻と M 殻のそれぞれに収容できる電子の最大数は同じである。
(2019年度センター試験 追試験 化学基礎 第1問問2 より引用)
