もくじ
確認テスト
問1
1 ~ 6 の原子のうち、以下の問題文に当てはまるものをそれぞれ答えましょう。
- 3Li
- 6C
- 10Ne
- 16S
- 17Cl
- 20Ca
ア 価電子の数が最小である原子
イ イオン化エネルギーが最小である原子
ウ 電子親和力が最大である原子
エ 電子配置が最も安定である原子
問2
次の化合物の化学式を書きましょう。
- 塩化銀
- 酸化銀
- 塩化カルシウム
- リン酸カルシウム
- 硫酸アンモニウム
- 酸化アルミニウム
問3
次の分子の化学式を書きましょう。
- 臭素
- ヨウ素
- 硫化水素
- 二酸化硫黄
- 酢酸
- メタン
- エタノール
問4
次の分子の電子式を書きましょう。
- H2
- H2O
- NH3
- CH4
- CO2
- N2
問5
次の分子の構造式と分子の形を考えましょう。
- H2
- H2O
- NH3
- CH4
- CO2
- N2
問6
次の物質はどの結晶に当てはまりますか。適当な選択肢を考えましょう。
- 塩化ナトリウム
- ダイヤモンド
- 銅
- ドライアイス
- 二酸化ケイ素
- 酸化カルシウム
- ヨウ素
A:イオン結晶 B:共有結合結晶 C:金属結晶 D:分子結晶
実践問題
問1(2015本第1問問4)
二つの原子 X と Z からなる分子 XZ の電子式を次に示した。XZ として最も適当なものを、下の①~⑤のうちから一つ選べ。ただし、X と Z は同じ原子であってもよい。

① HCl ② N2 ③ NO ④ O2 ⑤ F2
(2015年度センター試験 本試験 化学基礎 第1問問4 より引用)
問2(2018追第1問問5)
物質 A~C は、塩化カルシウム、グルコース(ブドウ糖)、二酸化ケイ素のいずれかである。物質 A~C について次の実験Ⅰ・Ⅱを行った。実験の結果から考えられる物質 A~C の組合せとして最も適当なものを、下の①~⑥のうちから一つ選べ。
実験Ⅰ 同じ質量の物質 A~C を別々のビーカーに入れ、それぞれのビーカーに同じ量の純水を加えてよくかき混ぜたところ、物質 A は溶けなかったが、物質 B と C は完全に溶けた。
実験Ⅱ 実験Ⅰで得られた物質 B と C の水溶液の電気伝導性を調べたところ、物質 C の水溶液のみ電気をよく通した。

(2018年度センター試験 追試験 化学基礎 第1問問5 より引用)
問3(2017本第1問問4)
結晶がイオン結晶でないものを、次の①~⑥のうちから一つ選べ。
① 二酸化ケイ素 ② 硝酸ナトリウム ③ 塩化銀
④ 硫酸アンモニウム ⑤ 酸化カルシウム ⑥ 炭酸カルシウム
(2017年度センター試験 本試験 化学基礎 第1問問4 より一部を引用)
問4(2016追第1問問1)
『銅イオン 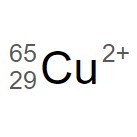 に含まれる電子の数』に当てはまるものを、下の①~⑥のうちから一つ選べ。
に含まれる電子の数』に当てはまるものを、下の①~⑥のうちから一つ選べ。
① 27 ② 29 ③ 31 ④ 36 ⑤ 63 ⑥ 65
(2016年度センター試験 追試験 化学基礎 第1問問1 より一部を引用)
問5(2015本第1問問6)
物質とそれを構成する化学結合との組合せとして適当でないものを、次の①~⑤のうちから一つ選べ。

(2015年度センター試験 本試験 化学基礎 第1問問6 より引用)
問6(2020追第1問問4)
固体の性質に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 金属は、たたいて薄く広げることや、引っ張って長く延ばすことができるものが多い。
② 共有結合の結晶(共有結合結晶)は、水に溶けにくいものが多い。
③ イオン結晶は、固体の状態でも電気をよく通すものが多い。
④ 分子結晶は、イオン結晶や共有結合の結晶と比べてやわらかいものが多い。
(2020年度センター試験 追試験 化学基礎 第1問問4 より引用)