イオン化エネルギーは、原子から 1 個の電子を取り去り、1 価の陽イオンにするのに必要なエネルギーです。
周期表の左下の元素は、イオン化エネルギーが小さい傾向があります。
イオン化エネルギーが小さい元素は、陽イオンになりやすいです。
電子親和力は、原子が 1 個の電子を受け取って、 1 価の陰イオンになるときに放出されるエネルギーです。
電子親和力は、周期表の右側の元素ほど大きい傾向があります。(希ガスは除く)
電子親和力が大きい元素は、陰イオンになりやすいです。
もくじ
イオン化エネルギー
イオン化エネルギーとは、(気体状態の)原子から 1 個の電子を取り去り、1 価の陽イオンにするのに必要なエネルギーのことをいいます。
原子核を構成する陽子は正の電荷をもっており、電子は負の電荷をもっています。そのため原子核と電子は、静電気的な引力がはたらいています。
引き合っているもの同士を引き離すので、そこにはエネルギーが必要です。ですから原子から電子を 1 個引き離して取り去るには、エネルギーが必要となります。
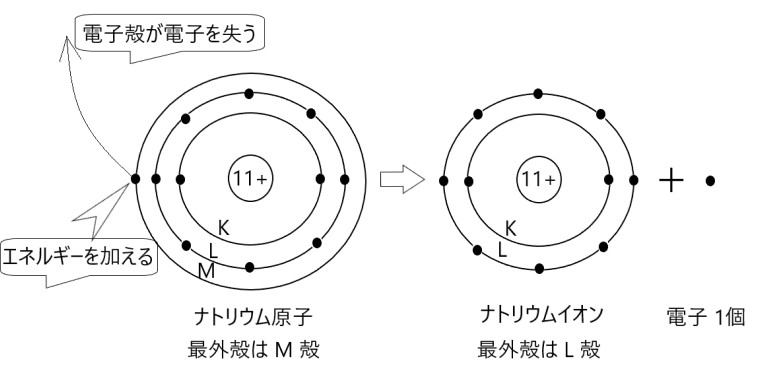
原子が陽イオンとなるときは、原子番号の近い希ガスの電子配置になります。
最外殻の電子がエネルギーを加えることによって取り去られるので、陽イオンになると一番外側の電子殻は電子のない空っぽの殻になります。
上の例では、ナトリウム原子にイオン化エネルギーの分だけエネルギーを加えると、最外殻である M 殻の電子が 1 個失われます。
原子は 1 価の陽イオンであるナトリウムイオンとなり、希ガスのネオンと同じ電子配置になります。このように、ナトリウムイオンの最外殻は L 殻になります。
陽イオンになりやすい元素
イオン化エネルギーの分だけエネルギーを加えると、原子は希ガスの電子配置をとって陽イオンになります。
では、どのような元素が陽イオンになりやすいのでしょうか。
希ガスの電子配置が安定なため、イオンになる原子は、最も原子番号が近い希ガスの電子配置になろうとします。
陽イオンになりやすいということは、電子を失ったときに簡単に希ガスの電子配置になりやすいということです。
ナトリウムやカリウムなどの 1 族元素は、1 個の電子を失うとそのまま希ガスの安定な電子配置になります。1 族元素は 1 個の電子を放出すれば、安定な電子配置になることができます。

一方、17 族元素のハロゲンはどうでしょうか。ハロゲンの原子は最外殻に電子を 7 個もっており、電子 1 個を放出しても、安定な希ガスの電子配置にはなれません。逆に安定な電子配置から遠ざかってしまいます。

このように、1 族元素のように 1 個の電子を放出することで、すぐに安定な電子配置になれる元素は陽イオンになりやすいです。
同じように最外殻電子数が 2 個の 2 族元素も、陽イオンになりやすいと考えられます。
逆に 17 族元素のハロゲンのように、1 個の電子を放出すると、安定な電子配置から離れてしまう元素があります。このような元素は、電子を失うと不安定な状態になるので、そのような変化は起こりにくいです。
最外殻電子数が 7 個の 17 族元素や、最外殻電子数が 6 個の 16 族元素は、電子を失う変化は起こりにくいので、陽イオンになりにくいです。
では 1 族の同族元素のなかでは、どの元素が陽イオンになりやすいのでしょうか。
1 族元素は第 1 周期が水素 H、第 2 周期がリチウム Li、以下ナトリウム Na、カリウム K、ルビジウム Rb‥‥と続きます。周期表の下にある元素ほど、最外殻が原子核から遠い距離にあります。
電子が 1 個、原子核の引力に逆らって離れていくとき、遠い位置にあった電子の方が離れやすいです。そのため、原子核のそばにある水素の K 殻の電子を 1 個引き離すより、カリウムの N 殻の電子を 1 個引き離す方が簡単です。

まとめると、周期表の左にある 1 族や 2 族の元素の方が、16 族や 17 族の元素より陽イオンになりやすいです。( 18 族の希ガスは安定な元素なので、陽イオンにはなりにくいです。)
同族元素では、周期表の下にある元素の方が陽イオンになりやすいです。
つまり、周期表の左下にある元素が、陽イオンとなりやすい傾向にあります。

イオン化エネルギーの値
周期表の左下にある元素が、陽イオンになりやすいです。実際のイオン化エネルギーの値を確かめてみましょう。

上の図は、横軸に原子番号順に元素を並べたものです。縦軸はイオン化エネルギーの大きさです。
グラフを見ると、1 族のイオン化エネルギーは小さく、17 族や 18 族のイオン化エネルギーが大きいことがわかります。
同じ周期の元素では、1 族から 18 族にかけてイオン化エネルギーが大きくなる傾向があります。
同じ族の元素では、原子番号が大きくなるとイオン化エネルギーが小さくなる傾向があります。
イオン化エネルギーを実際に測定すると、周期表の左下にある元素のイオン化エネルギーが小さいことがわかります。
イオン化エネルギーが小さいということは、原子から電子 1 個を取り去るのに必要なエネルギーが小さいということです。つまり簡単に電子が取り除かれ、陽イオンになります。
イオン化エネルギーが小さい元素は周期表の左下にあり、陽イオンになりやすいです。
電子親和力
電子親和力は、(気体状態の)原子が 1 個の電子を受け取り、1 価の陰イオンになったときに放出されるエネルギーです。
原子核は正電荷をもち、電子は負電荷をもつので、互いに引力がはたらきます。遠くにある電子が原子核の近くまで移動するとき、エネルギーを放出します。

エネルギーを放出するということは、低く安定したエネルギーの状態になるということです。
そのため、遠くの電子が原子核に引き寄せられ、電子殻に収まってエネルギーを放出すると、安定した状態になったといえます。
原子核から遠くにある電子が電子殻に収まり、エネルギーを放出するとき、より大きなエネルギーを放出すれば、よりエネルギーの低い安定な状態になったと考えられます。
原子がイオンになるときは、安定な希ガスの電子配置になろうとします。
例えば、ハロゲンは最外殻に電子を 7 個もつので、1 個の電子を受け取り最外殻の電子数を 8 個にすると、希ガスの電子配置になり安定した状態になります。
ハロゲンであるフッ素原子 F や塩素原子 Cl などは、電子を 1 個受け取れば安定な状態になるので、電子を受け取りやすく陰イオンになりやすい元素だと考えられます。

逆に 1 族のアルカリ金属は、1 個の電子を受け取ると最外殻の電子数が 2 個となり、安定な希ガスの電子配置からは遠ざかります。したがって、1 族元素は電子を受け取りにくく、陰イオンになりにくい元素だと考えられます。
陰イオンになりやすい元素
周期表でみると、右側の 17 族や 16 族といった元素は、電子を受け取ることで安定な電子配置に近づくので、陰イオンになりやすいです。
ただし希ガスである 18 族元素は、はじめから安定な状態なので電子を受け取らず、陰イオンにはなりにくいです。
周期表の左側の 1 族や 2 族の元素は、電子を受け取るとより不安定な電子配置になるので、陰イオンにはなりにくいです。

電子親和力の値
下のグラフは電子親和力の大きさを表したグラフです。縦軸は電子親和力のエネルギーの値で、横軸は原子番号順に元素が並んでいます。
実際に電子親和力を測定した値を見ると、17 族や 16 族の元素で電子親和力の値が大きくなっています。(ハロゲンのフッ素 F 、塩素 Cl 、臭素 Br 、ヨウ素 I が目立って高い値です。)

電子親和力が大きいので、電子を受け取ったときに大きなエネルギーを放出し、安定したエネルギーの低い状態になることがわかります。ハロゲンは電子を受け取り陰イオンになりやすいことが確認できます。
逆に、1 族や 2 族、18 族といった元素の電子親和力の値は小さいです。これらの元素は電子を受け取りにくく、陰イオンになりにくいです。
問題演習
確認テスト1
( )に入る適切な語句を考えましょう。
負電荷をもつ電子は、正電荷をもつ原子核と引き合っています。最外殻にある電子を取り去って、1 価の陽イオンにするのに必要なエネルギーを( A )といいます。
( A )の( B 大きい・小さい )原子は、電子が原子核に強く引きつけられているので、陽イオンになりにくいです。ネオンやアルゴンといった( C )、フッ素や塩素といった( D )は、( A )が( B )です。
( A )の( E 大きい・小さい )原子は陽イオンになりやすいです。リチウムやナトリウムなどの( F )は、陽イオンになりやすいです。
原子が 1 個の電子を受け取って、1 価の陰イオンになるときに放出されるエネルギーのことを( G )といいます。( G )が大きいと、電子を得たときに大きなエネルギーを放出して、低い安定なエネルギー状態になります。
したがって、( G )が( H 大きい・小さい )元素は、陰イオンになりやすいです。
17族元素の( I )は( G )が大きく、容易に希ガスの電子配置をとり、陰イオンになります。
希ガスは安定な元素なので陰イオンになりにくく、( G )は( J 大きい・小さい )です。
実践問題1(2018本第1問問1)
『 1 価の陽イオンになりやすい原子』に当てはまるものとして最も適当なものを、次の①~⑤のうちから一つ選べ。
① Be ② F ③ Li ④ Ne ⑤ O
(2018年度センター試験 本試験 化学基礎 第1問問1 より一部を引用)
実践問題2(2016本第1問問3)
図 1 は、典型元素の原子 a ~ f の電子配置の模式図を示している。a ~ f に関する記述として誤りを含むものを、下の①~⑤のうちから一つ選べ。


① a はアルカリ金属の原子である。
② b と f は同族元素の原子である。
③ c は a ~ f の中で、最もイオン化エネルギーが大きい。
④ e と f は第 3 周期の原子である。
⑤ e は 2 価の陽イオンになりやすい。
(2016年度センター試験 本試験 化学基礎 第1問問3 より引用)
