同族元素では、原子番号が大きい元素ほどその原子半径は大きい。
同一周期の元素では、原子番号が小さい元素ほどその原子半径は大きい。
同じ希ガスの電子配置のイオンでは、陰イオンの方が陽イオンよりそのイオン半径は大きい。
もくじ
原子の大きさを比べる
原子やイオンの大きさは、どのように決まるのでしょうか。原子がもつ電子殻の数や、原子核の周りにある電子の広がりから推測することができます。
同族元素の場合
同族元素の原子同士で大きさを比べるとき、考え方は簡単です。多くの電子殻をもつ原子は、原子の中心からより外側まで電子が広がっているので、原子は大きくなります。
周期表を縦に見たとき、下にある元素の原子ほど大きくなります。

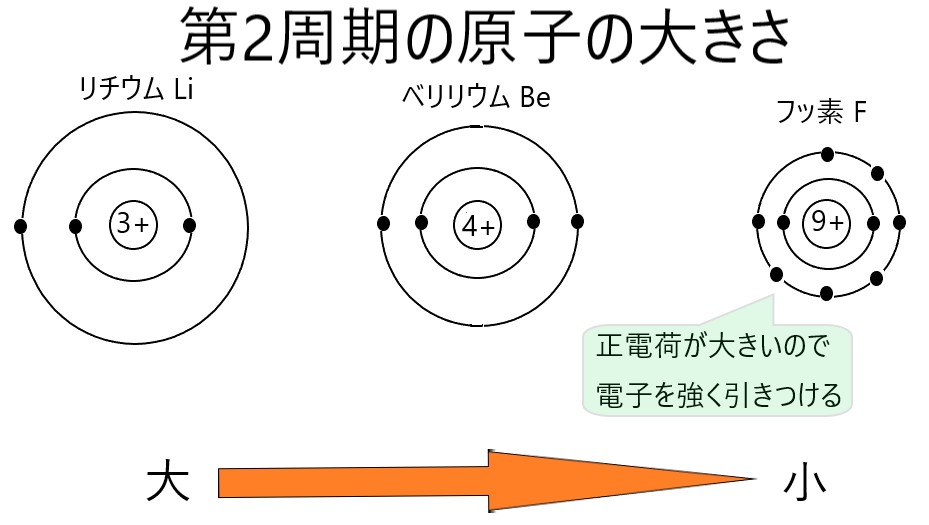
同一周期の元素の場合
同じ周期の元素は、最外殻になる電子殻が同じです。そして原子番号が大きくなるほど、原子核の正電荷が大きくなるので、より強い力で電子を引きつけると考えられます。
電子が強く引きつけられる原子では、最外殻の電子も原子核に引き寄せられ、原子の半径が小さくなります。そのため同一周期の元素では、原子番号が大きくなると原子は小さくなります。
周期表を横に見たとき、右にある元素の原子ほど小さくなります。
同じ電子配置の原子とイオンの場合
原子がイオンになるときは、最も原子番号の近い希ガスの電子配置となります。そこで、陽イオンと陰イオンと希ガスの原子が同じ電子配置となっています。
このとき電子の数は同じですが、原子核にある陽子の数は異なるため、それぞれの正電荷の値は差があります。
比較すると陽イオンの方が電子を強く引きつけ、陰イオンはあまり電子を引きつけなくなります。
そのため、陽イオンは最外殻の電子が原子の中心に強く引かれて、イオンの半径が小さくなります。
一方、陰イオンは最外殻の電子がそれほど引きつけられないので、イオンの半径は大きくなります。希ガスの原子はその中間です。
したがって電子配置が同じイオンと原子では、陰イオンは大きく、陽イオンは小さくなり、希ガスの原子はその間の大きさになります。

問題演習
確認テスト1
次の原子やイオンの大きさを比べましょう。
1. 同族元素であるベリリウム Be 、マグネシウム Mg 、カルシウム Ca の各原子
2. 同一周期の元素であるナトリウム Na 、アルミニウム Al 、塩素 Cl の各原子
3. 同じ電子配置であるフッ化物イオン F- 、ナトリウムイオン Na+ 、マグネシウムイオン Mg2+ の各イオン
