陽イオンと陰イオンが、静電気的な引力(クーロン力)で結びつくことをイオン結合といいます。
イオン結合によって陽イオンと陰イオンからできた物質(固体)を、イオン結晶といいます。
イオン結晶は一般に、融点が高く硬いです。しかし、特定の面に沿って割れやすい性質があります。
イオン結晶は、固体のままでは電気を通しません。しかし、融解して液体になると電気を通します。
イオン結晶を水に溶かすと、その水溶液は電気を通します。
イオン結晶は、組成式で表されます。組成式とは、イオン結晶を構成する陽イオンと陰イオンを、簡単な整数比で表記したものです。
もくじ
イオン結合
陽イオンは正電荷をもち、陰イオンは負電荷をもっているので、陽イオンと陰イオンは引き合います。
陽イオンと陰イオンが静電気的な引力(クーロン力)で結びつくことを、イオン結合といいます。
例えば、陽イオンであるナトリウムイオン Na+ と、陰イオンである塩化物イオン Cl- にはクーロン力がはたらいて、イオン結合します。
この結合により、塩化ナトリウム NaCl がつくられます。
ナトリウム原子 Na は容易に 1 個の電子を放出して、1 価の陽イオン Na+ になります。塩素原子 Cl は 1 個の電子を受け取り、簡単に 1 価の陰イオン Cl- になります。
Na+ と Cl- はクーロン力によりイオン結合し、NaCl のイオン結晶になります。
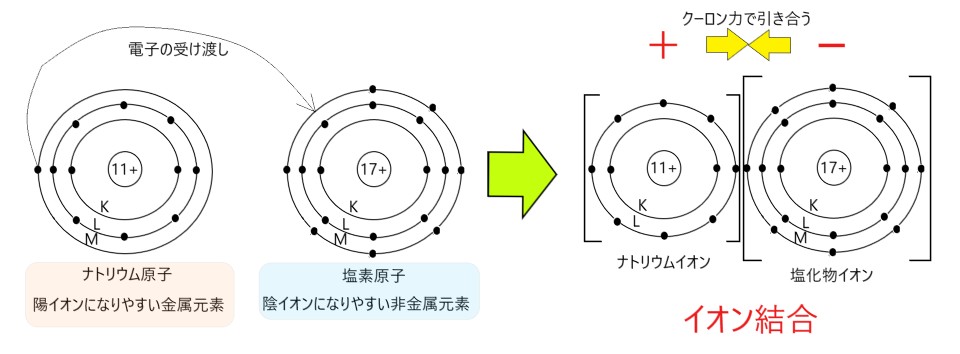
陽イオンになりやすいのは、1 族、2 族、13 族などの金属元素であり、陰イオンになりやすいのは、16 族、17 族などの非金属元素です。
そのためイオン結合は、金属元素と非金属元素の間でできやすいです。
イオン結晶
規則正しく並んでいる粒子でできた固体を、結晶といいます。このうち、陽イオンと陰イオンが規則正しく並んでできた固体を、イオン結晶といいます。
イオン結晶では、陽イオンと陰イオンはクーロン力によってイオン結合し、多数のイオンが配列しています。
イオン結晶は一般に、融点が高く硬いです。ただし硬いですが脆く、特定の面に沿って割れやすい性質があります。
これはイオン結晶に力がかかり、陽イオンと陰イオンの配列がずれると、静電気的な引力がはたらかなくなるためです。陽イオンと陰イオンの配列がずれると、静電気的な引力が反発に変わってしまうので、結晶が割れます。

イオン結晶は、固体のままでは電気を通しません。しかし、融解して液体になると電気を通します。液体の状態では、陽イオンと陰イオンが自由に動けるようになるので、電気を通すのです。
また、イオン結晶は水に溶けるものが多いです。イオン結晶を水に溶かすと、水溶液中で陽イオンと陰イオンに分かれるので、その水溶液は電気を通します。
組成式
イオン結晶は、組成式で表されます。組成式とは、イオン結晶を構成する陽イオンと陰イオンを、簡単な整数比で表記したものです。
物質としてのイオン結晶は電気的に中性なので、陽イオンのもつ正電荷の総和と、陰イオンのもつ負電荷の総和がつり合っています。
つまり、
陽イオンの価数 × 陽イオンの数 = 陰イオンの価数 × 陰イオンの数
となります。
例えば、塩化ナトリウム NaCl はイオン結晶です。1 価の陽イオン Na+ が 1 個と、1 価の陰イオン Cl- が 1 個から結晶 NaCl ができると、電気的に中性となります。
Na+ 1 価 × 1 個 = Cl- 1 価 × 1 個
組成式のつくり方
では、具体的に組成式のつくり方をまとめます。
イオン結晶である塩化カルシウム CaCl2 の組成式を例につくってみましょう。
① 正電荷と負電荷の総和が等しくなるように、陽イオンと陰イオンの比を考える。
陽イオンはカルシウムイオン Ca2+ で、これは 2 価の陽イオンです。陰イオンは塩化物イオン Cl- で、これは 1 価の陰イオンです。
Ca2+ 2 価 × 1 個 = Cl- 1 価 × 2 個
カルシウムイオン 1 個に対して塩化物イオンが 2 個あると、結晶は電気的に中性です。
② 元素記号の右下に整数比を書く。( 1 は省略)
カルシウムイオンは 1 個なので、右下に 1 とは書かずに省略します。塩化物イオンは 2 個なので、Cl の右下に 2 と書きます。
Ca + Cl2
多原子でできたイオンの場合は、個数を右下に書くとき、イオンを括弧で囲みます。
③ 陽イオン、陰イオンの順に書く。(読み方は陰イオンから陽イオンの順)
陽イオンの Ca が先で、あとに陰イオンの Cl2 をくっつけて CaCl2 とします。
ただし読み方は『~イオン』『~化物イオン』のうち、「イオン」と「物イオン」を取り除き、陰イオンから陽イオンの順で~化~と読みます。
今回の例では、陰イオンの『塩化物イオン』から「物イオン」をとり、陽イオンの『カルシウムイオン』から「イオン」をとり、塩化カルシウムと読みます。
イオン結晶の組成式の例を示します。
| 名称 | 陽イオン | 陰イオン | 組成式 |
| 塩化ナトリウム | Na+ | Cl- | NaCl |
| 塩化マグネシウム | Mg2+ | Cl- | MgCl2 |
| 水酸化カルシウム | Ca2+ | OH- | Ca(OH)2 |
| 硫酸カリウム | K+ | SO42- | K2SO4 |
| 硫酸カルシウム | Ca2+ | SO42- | CaSO4 |
| 硫酸アルミニウム | Al3+ | SO42- | Al2(SO4)3 |
| リン酸アンモニウム | NH4+ | PO43- | (NH4)3PO4 |
| リン酸カルシウム | Ca2+ | PO43- | Ca3(PO4)2 |
| リン酸アルミニウム | Al3+ | PO43- | AlPO4 |
問題演習
確認テスト1
次の( )に入る適切な語句を考えましょう。
陽イオンと陰イオンの間には( A )がはたらき、イオン結合ができます。イオン結合によってできた結晶を( B )といいます。( B )は、周期表左側の陽イオンになりやすい( C )と、右側の陰イオンになりやすい( D )からできることが多いです。
( B )は一般に融点が( E 高い・低い )です。また( F 硬い・柔らかい )ものの、脆く割れやすいです。固体は電気を( G 通す・通さない )が、融解すると電気を( H 通す・通さない )性質があります。
確認テスト2
以下のイオン結晶の表を完成させましょう。
| 名称 | 陽イオン | 陰イオン | 組成式 |
| Na+ | NaCl | ||
| Mg2+ | Cl- | ||
| 水酸化カルシウム | |||
| K+ | SO42- | ||
| Ca2+ | CaCl2 | ||
| 硫酸アルミニウム | SO42- | ||
| リン酸アンモニウム | |||
| リン酸ナトリウム | Na+ | Na3PO4 | |
| Al3+ | PO43- |
実践問題1(2016追第1問問4)
イオン結晶の性質の記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① 融点の高いものが多い。
② 電気をよく通す。
③ 硬いが、割れやすくもろい。
④ 結晶中では、陽イオンと陰イオンが規則正しく並んでいる。
⑤ 水に溶かすと、陽イオンと陰イオンに電離する。
(2016年度センター試験 追試験 化学基礎 第1問問4 より引用)
