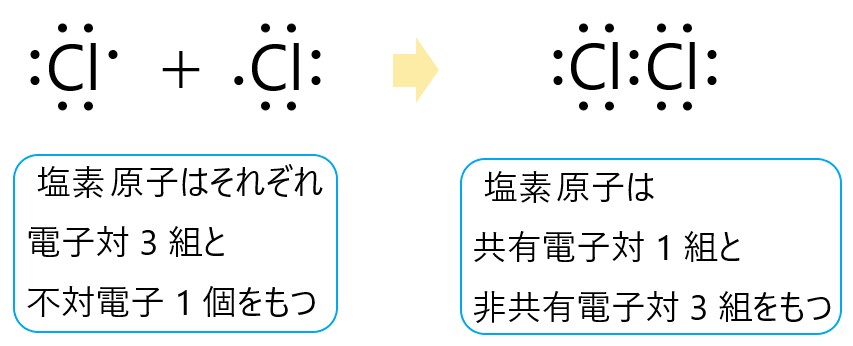
2 つの原子が、最も外側にもつ電子を出し合って共有することで、原子同士がつながることを共有結合といいます。
それぞれの原子は、安定な希ガスの電子配置になるように電子を共有します。
一般に共有結合は、非金属元素の原子同士でつくられます。
共有結合でいくつかの原子が結びついてできた粒子を、分子といいます。
1 個の原子でできた分子を単原子分子、2 個の原子でできた分子を二原子分子、3 個以上の原子でできた分子を多原子分子といいます。
分子式とは、分子を構成している原子を元素記号で書き、その原子の個数を右下に付けて表した式です。
電子式とは、原子の価電子(最外殻の電子)を点で表示した式です。
電子式で、2 個の電子の組を電子対、1 個だけある電子を不対電子といいます。
原子が不対電子を出し合って共有している電子対を、共有電子対といいます。共有していない電子対は、非共有電子対といいます。
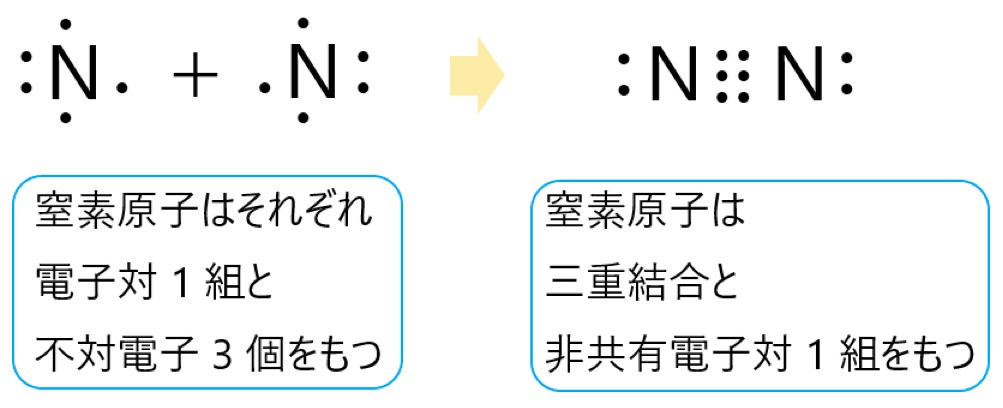
原子同士が 2 つの共有電子対をもち結合しているとき、これを二重結合といいます。同様に 3 つの共有電子対をもち結合しているとき、これを三重結合といいます。
もくじ
共有結合
原子と原子が近づいたときに、それぞれが最も外側にもつ電子を出し合って共有することで、原子同士がつながることを共有結合といいます。
共有結合とは(イオン結合との違い)
イオン結合では、陽イオンになりやすい原子が電子を放出して、陰イオンになりやすい原子が電子を受け取りました。
そして陽イオンと陰イオンの間でクーロン力がはたらくので、その引力によって結合していました。
代表的な例では、陽イオンになりやすい金属元素のナトリウム Na が電子を放出し Na+ となり、陰イオンになりやすい非金属元素の塩素 Cl が電子を受け取り Cl- となり、塩化ナトリウム NaCl が生じます。
塩化ナトリウムは、イオン結合で結びついたイオン結晶でした。

さて共有結合では、原子同士がそれぞれの電子を提供して、これらの電子を共有することで原子がつながります。ではなぜ、電子を共有するのでしょうか。
一般にイオン結合は、陽イオンと陰イオンになりやすいので、金属元素と非金属元素の間でできる結合です。
もし非金属元素同士が結合するなら、どうやってできるのでしょうか。非金属元素の原子が 2 つあったとき、これらはどちらも電子を受け取りたがる原子です。
そこで、どちらも電子を受け取るような形で結合させてみましょう。
それぞれの原子が相手の電子を受け取り、その電子を共有する形なら、電子を受け取りたがる非金属元素の原子でも結合ができます。
2 つの非金属元素の原子が電子を受け取り、電子を共有して安定な状態をつくれるなら、共有結合が完成します。

原子は希ガスの電子配置になると安定なので、原子番号の近い希ガスの電子配置をとろうとします。
これは、第 1 周期の水素 H なら、ヘリウム He と同じように最外殻( K 殻)の電子数を 2 個にしようとします。
第 2 周期以降の元素なら、ネオン Ne の最外殻( L 殻)8個、アルゴン Ar の最外殻( M 殻)8個、クリプトン Kr の最外殻( N 殻)8 個、‥‥と同じように、最外殻の電子数を 8 個にしようとします。


まとめると、水素 H は最外殻が 2 個の電子配置なら安定なので、最外殻が 2 個になろうとします。それ以外の元素では最外殻が 8 個の電子配置なら安定なので、最外殻が 8 個になろうとします。
非金属元素の原子は、相手の電子を受け取って共有し、安定な希ガスの電子配置をとることで、強い共有結合をつくれます。
分子
共有結合でいくつかの原子が結びついてできた粒子を、分子といいます。
上の項で説明したように、それぞれの原子が安定な電子配置をとるように、共有結合で(非金属元素の)原子はつながります。
こうしてつながってできたものが分子です。水や二酸化炭素、アンモニア、メタン、エタノールなどが分子です。
共有結合で分子ができる例を確認しましょう。
水素分子 H2 は水素原子 H が 2 個共有結合してできた分子です。水素原子 H は原子番号 1 の電子を 1 個もつ原子であり、最外殻は K 殻で電子が 1 個あります。
この水素原子はヘリウム He のように最外殻の電子数が 2 個になると安定です。
そこで 2 個の水素原子が、K 殻の電子を 1 個ずつ提供し、それら 2 個の電子をそれぞれの原子が共有します。そうすると最外殻に 2 個の電子が入り、2 つの原子がともに安定となります。
電子殻に 2 個の電子を共有するので 、2 個の原子は一定の距離を保ちます。正の電荷をもつ原子核と、共有する 2 つの電子を通して、水素原子はたがいに引き合い結合を形成します。

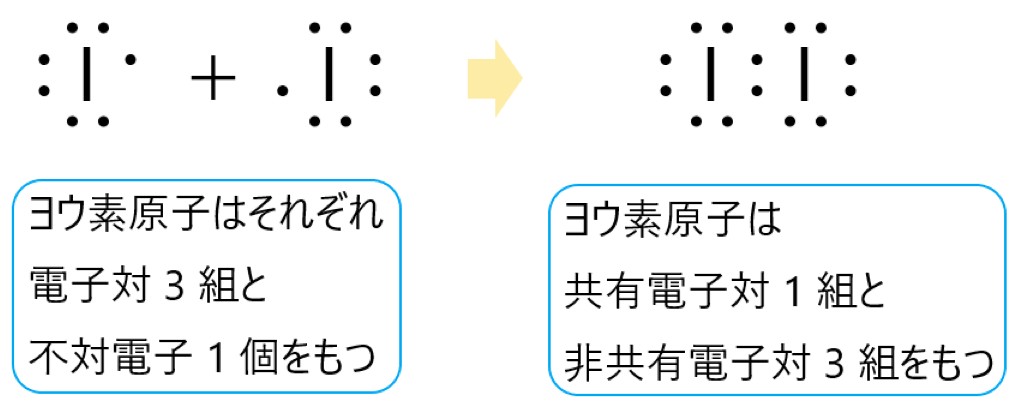
フッ素分子 F2 はフッ素原子 F が 2 個共有結合してできた分子です。フッ素原子 F は原子番号 9 の電子を 9 個もつ原子であり、最外殻は L 殻で電子が 7 個あります。
このフッ素原子は、ネオン Ne のように最外殻の電子数が 8 個になると安定です。
そこで 2 個のフッ素原子が、L殻の電子を 1 個ずつ提供し、その 2 個の電子をそれぞれの原子が共有します。
すると、それぞれの原子の最外殻電子数は 8 個となり、2 つの原子がともに安定となります。
電子殻に 2 個の電子を共有するので、 2 個の原子は一定の距離を保ちます。正の電荷をもつ原子核と、共有する 2 つの電子を通して、フッ素原子はたがいに引き合い結合を形成します。

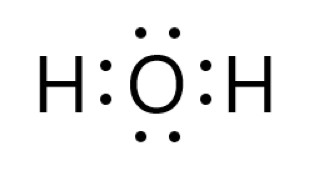
水分子 H2O は、1 個の酸素原子と 2 個の水素原子が共有結合してできた分子です。
酸素原子は原子番号 8 で最外殻( L 殻)に電子を 6 個もち、2 個の電子を受け取って共有すれば、安定な電子配置になります。
水素原子は最外殻の電子が 1 個で、さらに 1 個電子を受け取れば安定です。水素原子は分子内に 2 個あるので、2 個の水素原子がそれぞれ酸素原子と共有結合をつくります。


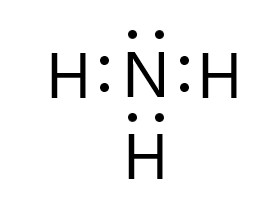
アンモニア NH3 は 1 個の窒素原子と 3 個の水素原子が共有結合してできた分子です。窒素原子は原子番号 7 で最外殻( L 殻)に電子を 5 個もち、3 個の電子を受け取って共有すれば、安定な電子配置になります。
水素原子は最外殻の電子が 1 個で、さらに 1 個電子を受け取れば安定です。水素原子は分子内に 3 個あるので、3 個の水素原子がそれぞれ酸素原子と共有結合をつくります。


分子の種類
分子は何個の原子からできているかで、名称がつけられています。1 個の原子でできた分子を単原子分子といいます。単原子分子は、1 個だけでも安定な希ガスが代表例です。
2 個の原子でできた分子を二原子分子といいます。水素や酸素、窒素、塩素などが二原子分子です。
3 個の原子でできた分子を三原子分子、また 3 個以上の原子でできた分子を多原子分子といいます。水は三原子分子で、アンモニアは多原子分子です。
分子式
分子は構成している原子を元素記号で書き、その原子の個数を右下に付けることで表記できます。この式を分子式といいます。ただし 1 個の原子は数を省略します。
分子式で表すと、単原子分子ではヘリウム He やネオン Ne となります。二原子分子では、それぞれ原子が 2 個あるので、水素 H2 や酸素 O2 、窒素 N2 、塩素 Cl2 と表されます。
三原子分子では、水 H2O (水素原子 2 個と酸素原子 1 個)や、二酸化炭素 CO2 (炭素原子 1 個と酸素原子 2 個)と表されます。
多原子分子では、アンモニア NH3 (窒素原子 1 個と水素原子 3 個)、メタン CH4 (炭素原子 1 個と水素原子 4 個)、エタノール C2H6O(炭素原子 2 個と酸素原子 1 個と水素原子 6 個)のように分子式で書くことができます。
電子式
共有結合をつくるには、原子の最外殻に注目して、最外殻の電子が 8 個(水素原子では 2 個)になるように、電子を共有すればよいのでした。
それならば各原子の最外殻の電子数だけ考えれば、共有結合でできた分子について簡単に考察できます。
そこで原子の価電子(最外殻の電子)を点で表示した式をつくりました。この式を電子式といいます。
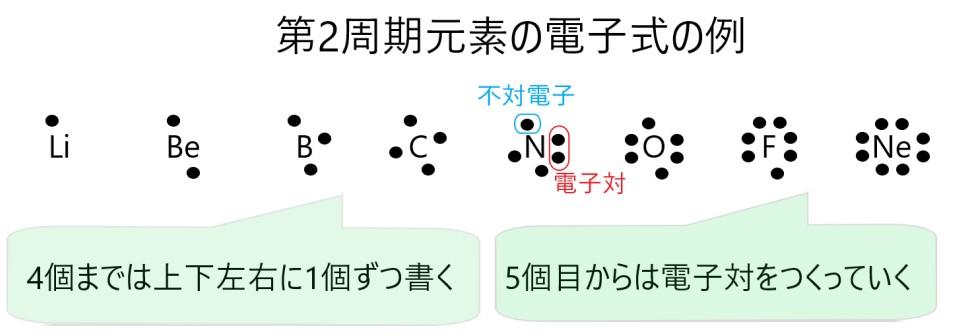
電子式では、原子の元素記号の周りに、最外殻の電子数と同じ数だけ点をつけます。
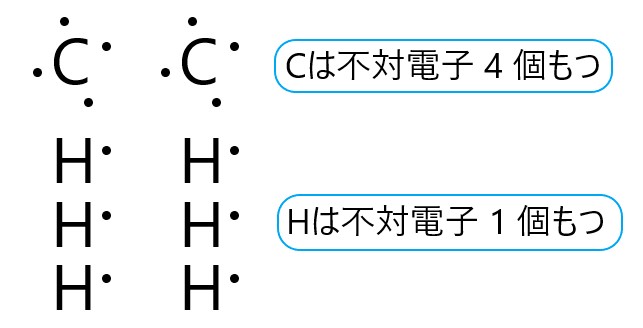
電子は 2 個で 1 つの組とし、この組のことを電子対といいます。組にならずに 1 個だけの状態の電子は、不対電子といいます。原子は最大で 4 つの電子対をもちます。
4 つの電子対は、元素記号の上下左右に書きます。最外殻電子は 1 個増えるごとに 1 個ずつ上下左右に割り振り、5 個目の電子からは電子対をつくっていきます。
共有結合では、それぞれの原子がもつ不対電子が提供されて、電子が 2 つ揃い電子対をつくります。こうして原子間で共有された電子対のことを、共有電子対といいます。また、原子に共有されていない電子対は、非共有電子対といいます。

二重結合と三重結合
電子式で共有電子対として表されるものが、原子と原子をつなぐ共有結合でした。1 個の不対電子と 1 個の不対電子が電子対をつくり共有結合となったとき、これを単結合といいます。
1 個の原子は最大で 4 つの電子対をもつので、複数の共有結合をもつことができます。
ある原子とある原子の間で 2 つの共有電子対をもつとき、共有結合が 2 つできていることになります。この状態を二重結合といいます。
同様に原子間で共有結合が 3 つできているとき、これを三重結合といいます。
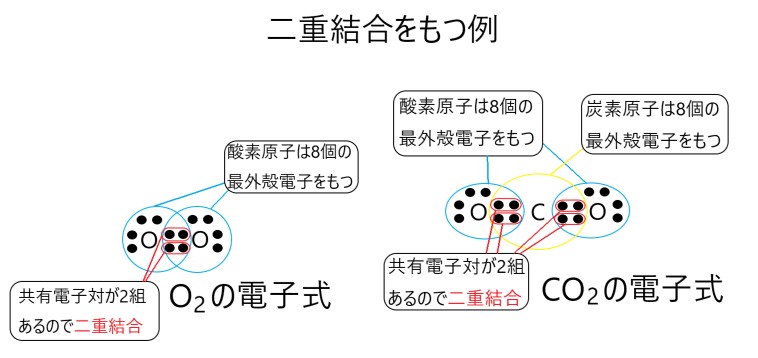
二重結合の例には、酸素 O2 や二酸化炭素 CO2 などがあります。
酸素原子は電子対を 2 組と不対電子を 2 個もちます。酸素分子は、2 つの酸素原子がそれぞれ 2 個の不対電子を提供し、二重結合をつくってできています。
分子である二酸化炭素は、炭素原子 1 個と酸素原子 2 個からできています。炭素原子は不対電子を 4 個もちます。酸素原子の 2 個の不対電子と、炭素原子の 2 個の不対電子から、二重結合がつくれます。この二重結合をふたつもつ分子が二酸化炭素です。
三重結合の例には、窒素 N2 やアセチレン C2H2 などがあります。
窒素原子は、電子対を 1 組と不対電子を 3 個もちます。2 個の窒素原子が不対電子を 3 個ずつ出し合って共有すると、三重結合ができます。窒素分子は、三重結合でできた二原子分子です。
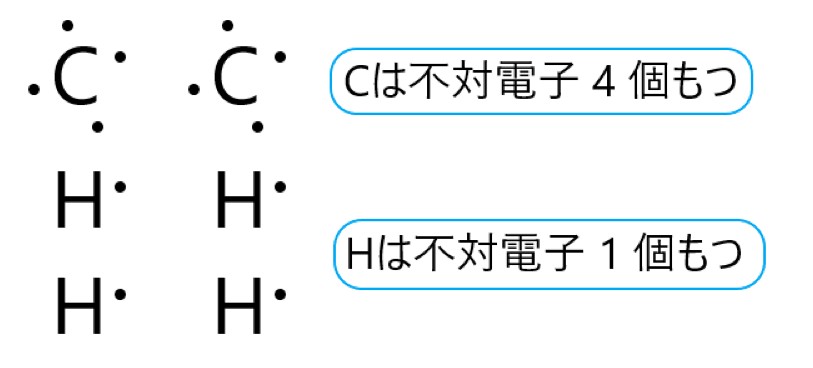
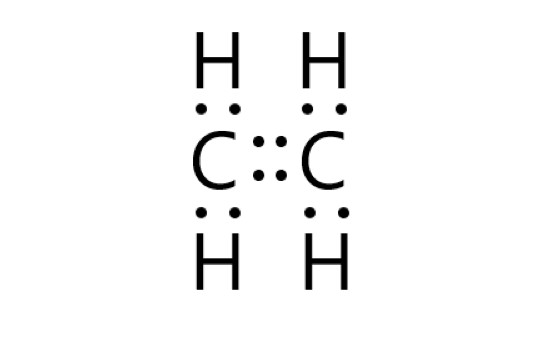
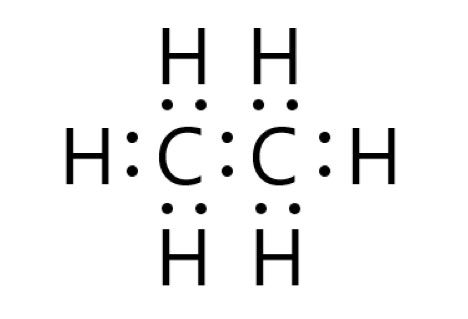
アセチレンは、炭素原子が 2 個と水素原子が 2 個からできた分子です。炭素原子は 4 個の不対電子を、水素原子は 1 個の不対電子をもちます。
炭素原子と水素原子は不対電子を 1 個ずつ提供して、単結合をつくっています。炭素原子と炭素原子は、3 つの不対電子をそれぞれ出し合い、3 つの共有電子対をつくります。これが三重結合になっています。

問題演習
確認テスト1
次の文章の空欄を適当な語句で補いましょう。
陽イオンと陰イオンが互いに、クーロン力で引き合ってできているのが、イオン結合です。一方、非金属元素の原子同士が、それぞれ電子を提供してできているのが( A )です。
( A )では、原子の最外殻電子が結合に関与するので、最外殻電子を点で表した電子式が考えられました。電子式では、2つの電子が組になったものを電子対、1個の電子が単独で存在しているものを( B )といいます。
( A )は、それぞれの原子が( B )を出し合ってつくります。このように互いの原子に共有された電子対を( C )、結合に関与していない電子対を( D )といいます。
1 つの( C )で結びついた結合を( E )、2つの( C )で結びついた結合を二重結合、3つの( C )で結びついた結合を( F )といいます。
それぞれの原子は、安定な( G )の電子配置をとるように( A )をつくります。
いくつかの原子が( A )により結合した粒子のことを、分子といいます。1 個の原子からなる分子を( H )、2 個の原子からなる分子を( I )、3 個以上の原子からできている分子を多原子分子といいます。
確認テスト2
次の分子の分子式を書きましょう。
| 水素 | H2 |
| 酸素 | |
| オゾン | |
| 塩素 | |
| 臭素 | |
| ヨウ素 | |
| 一酸化炭素 | |
| 塩化水素 | |
| 硫化水素 | |
| 二酸化窒素 | |
| 一酸化窒素 | |
| 過酸化水素 | |
| エチレン |
確認テスト3
次の原子や分子を電子式で表しましょう。
- ヘリウム He
- 第3周期元素の原子
- 塩素 Cl2
- 水 H2O
- アンモニア NH3
- 酸素 O2
- 窒素 N2
- エチレン C2H4
- 過酸化水素 H2O2
実践問題1(2016追第1問問1)
『図 1 の電子式で表される A の元素名』に当てはまるものを、次の①~⑥のうちから一つ選べ。

① 酸素 ② フッ素 ③ アルミニウム
④ ケイ素 ⑤ リン ⑥ アルゴン
(2016年度センター試験 追試験 化学基礎 第1問問1 より一部を引用)
実践問題2(2019追第1問問1)
『三重結合をもつ分子』に当てはまるものとして最も適当なものを、次の①~④のうちから一つ選べ。
① N2 ② I2 ③ C2H4 ④ C2H6
(2019年度センター試験 追試験 化学基礎 第1問問1 より一部を引用)
実践問題3(2018追第1問問2)
非共有電子対の数が最も多い分子を、次の①~⑤のうちから一つ選べ。
① N2 ② NH3 ③ H2O
④ Cl2 ⑤ C2H4
(2018年度センター試験 追試験 化学基礎 第1問問2 より引用)