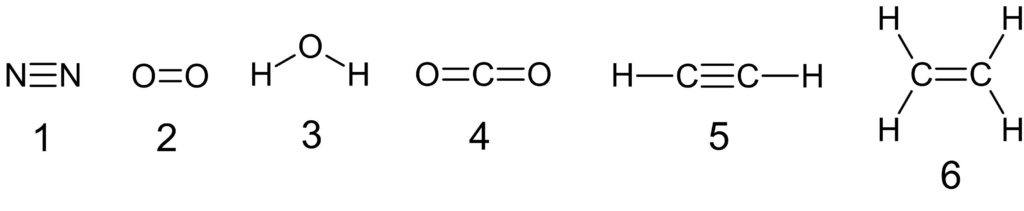
共有結合を 1 本の線で表現した式を、構造式といいます。また、この線を価標といいます。
構造式は原子の元素記号と価標だけで表され、非共有電子対は省略します。
構造式では、二重結合を 2 本の線、三重結合を 3 本の線で表します。
構造式において、原子から出ている価標の数を原子価といいます。
原子価は、その原子がつくれる共有結合の数と等しく、その原子がもつ不対電子の数と同じです。
もくじ
構造式
ふたつの原子が、それぞれの不対電子を提供して共有すること(共有電子対)で、共有結合が生じました。
電子式では、共有結合を 2 個の点の組で表しています。このとき、共有結合の電子 2 個の点の組を、1本の線で表した式を構造式といいます。
電子式より構造式の方が、さらに簡単に原子の結合を表現できます。
構造式では、 1 つの共有電子対を 1 本の線で表しますが、この線のことを価標といいます。
共有結合を価標で表すので、単結合は 1 本の線、二重結合は二重線、三重結合は三重線となります。
また構造式では簡単にするために、非共有電子対は表記しません。そこで構造式は、原子の元素記号と共有結合を表す価標だけ用いられます。

原子価
構造式において、原子から出ている価標の数を原子価といいます。
価標はその原子がつくる共有結合を意味していますので、価標の数はその原子がつくれる共有結合の数と同じです。
原子価は、その原子の価標の数であり、その原子がつくれる共有結合の数であり、その原子がもつ不対電子の数ということです。
原子番号 20 までの元素を、簡略にした下の周期表にまとめました。
族番号の 1 の位の値と、最外殻電子数は一致します。(ヘリウム He の最外殻電子数は 2 で例外)
価電子の数も、族番号の 1 の位の値と一致します。(希ガスの 18 族は価電子の数が 0 で例外)

共有結合をつくるときに重要なのは、不対電子です。原子が不対電子を出し合って共有結合をつくるので、不対電子の数だけ共有結合ができます。
電子式から考えるとわかるように、不対電子の数は 1 族から 14 族までは 1 から 4 まで増え、15 族から 18 族までは 3 から 0 まで減ります。
例として、ヘリウム He と第 2 周期元素の電子式をあげます。

つくれる共有結合の数(原子価)も、1 族から 14 族までは 1 から 4 まで増えて、15 族から 18 族までは 3 から 0 まで減ることになります。
原子から原子価の数だけ線が出て、共有結合をつくります。

構造式の書き方
構造式の書き方のポイントは、
① 原子価の数だけ(不対電子の数だけ)、原子から線を引く。
② 原子同士でその線を結びつけて、分子をつくる。(非共有電子対は略して書かない。)
と、これだけです。
ただし、分子にはそれぞれ特有の形があるので、それを考慮して構造式を書くことがあります。(分子の形は後の項目で学びます。)
例えば水分子 H2O の形は、3 つの原子が直線上に並んでおらず、くの字のように折れています。構造式は H-O-H と書きますが、分子の形を意識したときは折れ曲がった構造式を書くこともあります。

二酸化炭素 CO2 の分子は、3つの原子が一直線に並んだ形です。そのため、構造式は O = C = O とまっすぐに書きます。

酸素原子の原子価は 2 、炭素原子の原子価は 4 なので、右側の直角に曲がった構造式でも価標の数は間違っていません。しかし CO2 の構造式を、このように曲げて書くことはありません。
エチレン C2H4 という分子は、二重結合を 1 つもつ分子です。それぞれの共有結合は、約 120 度の角度でつながっています。

エチレンの構造式は、実際の分子の形に似た右上のように書くことがあります。また右下の二つの構造式のように、直角に曲がった形で表すこともあります。
右下の二つの構造式は分子の形と少し違うにもかかわらず、全く問題なく使われています。
これは、構造式を書く人も構造式を読む人もエチレンの形はわかっているので、これらの構造式の違いを気にしないためです。
エチレンのような分子の場合は、上の例の 3 つの構造式は、誰も気にせずどれでも使います。習慣として、共有結合同士の角度は気にしません。
上の三つの分子の例で分かるように、構造式で原子同士を結ぶ価標をどういう角度で書くかは、これまでの慣習やその構造式が使われている場面によります。
分子の形が理解できるまでは、教科書や参考書に書かれている構造式をそのまま利用すると良いでしょう。
問題演習
確認テスト1
次の分子の構造式を考えてみましょう。
- 塩素 Cl2
- 窒素 N2
- 塩化水素 HCl
- アンモニア NH3
- メタン CH4
- プロパン C3H8
- アセチレン C2H2
実践問題1(2017本第1問問3)
単結合のみからなる分子を、次の①~⑥のうちから一つ選べ。
① N2 ② O2 ③ H2O
④ CO2 ⑤ C2H2 ⑥ C2H4
(2017年度センター試験 本試験 化学基礎 第1問問3 より引用)
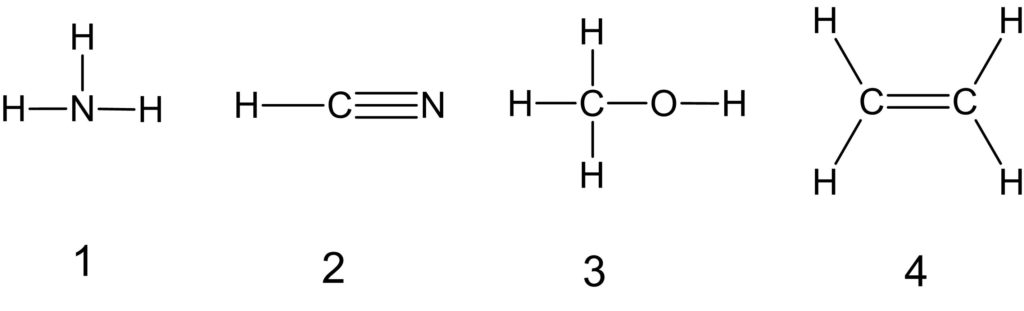
実践問題2(2020追第1問問1)
共有結合に使われている電子の総数が最も多い分子を、次の①~④のうちから一つ選べ。
① NH3 ② HCN ③ CH3OH ④ C2H4
(2020年度センター試験 追試験 化学基礎 第1問問1 より引用)