分子の形は、分子を構成する原子がどういう角度で共有結合しているかで決まります。
原子を取り囲む電子対は負電荷をもち、電子対同士で反発します。共有結合は反発が最も小さくなる方に向きます。
原子の周りに4つの電子対があると、反発を避けて正四面体の頂点の方向に結合ができます。
二重結合や三重結合は、電子のひとかたまりと考え、他の電子対と距離をとります。
もくじ
分子の形の考え方
分子にはそれぞれに特有の形があります。では、分子の形とはそもそも何でしょうか。
分子はいくつかの原子が結合してできた粒子です。ですから、原子という小さい粒子がどのように並んでつながっているか、を考えると分子の大まかな形がわかります。
原子と原子は共有結合でつながっているので、その共有結合がどのくらいの長さでどの方向を向いているかを知れば、分子の形を考えることができます。
共有電子対の向き
共有結合は、原子と原子の間にある共有電子対でできています。そこで、分子内の共有電子対がどういう方向にあるのかを見てみましょう。
例としてメタン CH4 という分子を考えます。これは中心に炭素原子が 1 個あり、炭素原子のまわりに水素原子が 4 個結合しています。
メタン CH4 の構造式を書くと、平面上に 90 度の角度をとって、炭素原子と水素原子が結合していそうです。しかし実際には、正四面体のように立体的な形をしています。

なぜメタンは平面上の十字の形ではなく、立体的な正四面体形になるのでしょうか。
ここで、メタンに 4 つある共有電子対が関与してきます。共有電子対は負の電荷をもつので、メタン分子内の 4 つの共有電子対は、それぞれの負電荷が反発しています。
このとき共有電子対同士の反発が最も小さくなるように、共有電子対は空間に配置されます。
炭素原子の周りの 4 組の共有電子対が最も距離をとるのは、水素原子が正四面体の頂点の位置にあるときです。
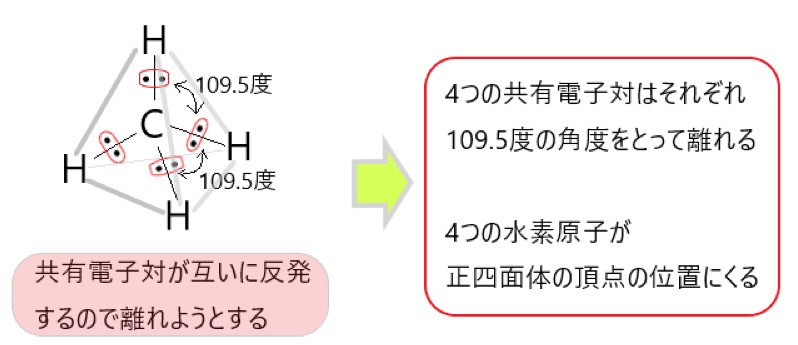
このように、4 つの共有電子対が互いの負電荷の反発を避けようとすると、中心に炭素原子を置き、頂点に水素原子がある正四面体形になります。
原子という粒子が集まったものが分子ですから、水素原子が正四面体の頂点にあるとき、メタン分子は正四面体形であるといえます。
非共有電子対がある分子
次にアンモニア NH3 分子の形を考えます。
アンモニアは、窒素原子 1 個が 3 個の水素原子と共有結合しています。それに加えて、窒素原子は 1 組の非共有電子対をもっています。
メタンでは負電荷の共有電子対同士が反発して、その反発を避けるように共有結合の方向が決まりました。
そのため非共有電子対があるときも、同じように負電荷の反発を避けようとします。
窒素原子の周りには、1 組の非共有電子対と 3 組の共有電子対があります。
そこで、この合計 4 組の電子対が、互いに負電荷の反発を避けようとします。すると、窒素原子を中心として、3 個の水素原子が正四面体の頂点に位置します。
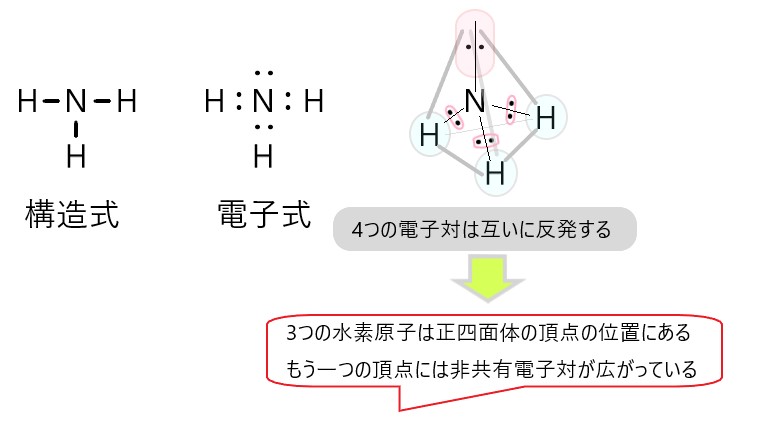
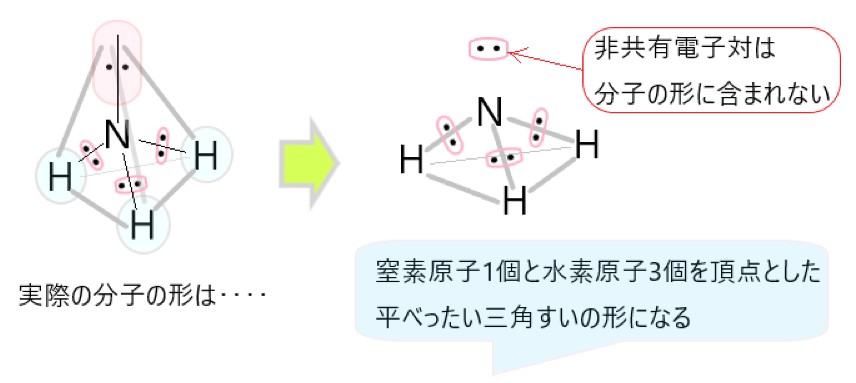
このとき残りひとつの頂点の位置には、窒素原子の非共有電子対が占めます。
こうしてアンモニア分子では、窒素原子を中心とし、正四面体の頂点に 3 つの水素原子と 1 組の非共有電子対が位置することになります。
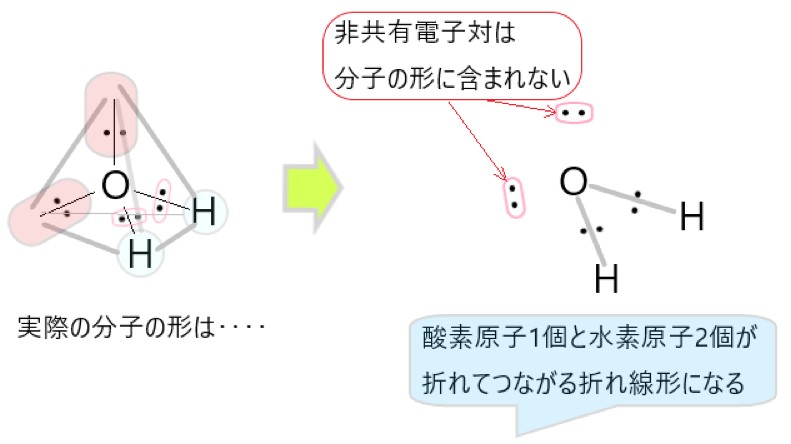
ただ分子の形を考えるときは、分子をつくっている原子の並びだけを見ます。非共有電子対は分子のしっかりした形とはみなせないので、非共有電子対が占める空間は無視します。
したがってアンモニア分子は、窒素原子を頂点とした三角錐の形になります。
水 H2O 分子も、アンモニア分子と同様に考えることができます。
中心となる酸素原子の周りには、共有電子対で結合した 2 個の水素原子と、2 組の非共有電子対があります。
酸素原子の周りには 4 組の電子対があるので、これらが互いの負電荷の反発を避けようとすると、正四面体形になります。
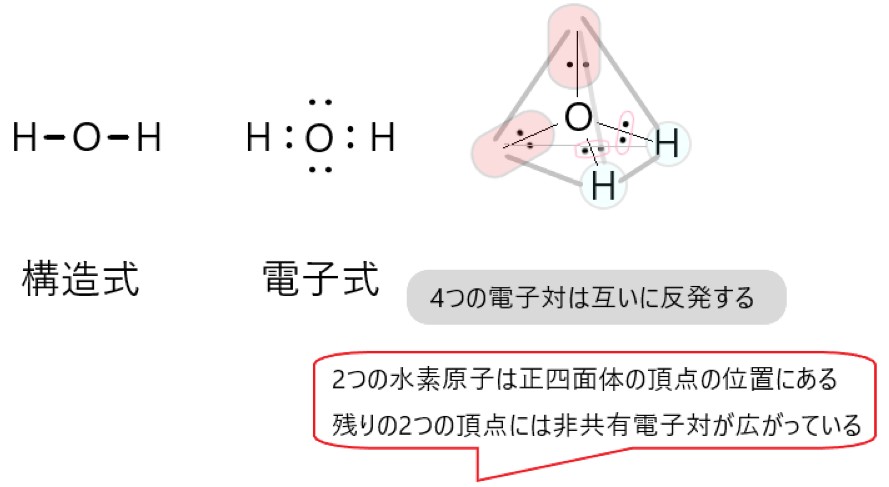
実際に分子を構成するのは 2 個の水素原子と 1 個の酸素原子なので、非共有電子対の部分は無視すると、水分子の形は折れ線形になります。
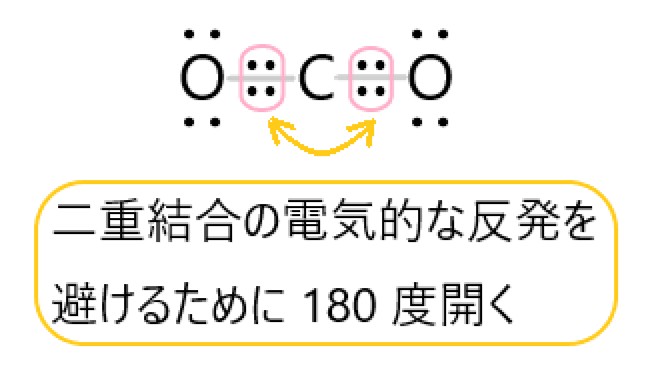
二重結合がある分子
二重結合や三重結合がある分子の形は、どうなっているのでしょうか。
二重結合では、原子と原子の間に 2 組の共有電子対があります。分子の形を考えるときには、二重結合をつくっている 4 個の電子を、ひとつのまとまりと見てかまいません。
(原子間のどこに4個の電子が存在するかは、本当はもう少し細かく決まっていますが、ここではそこまで考えなくても良いです。)
エチレン C2H4 分子を例にして説明します。エチレンは炭素原子の間に二重結合があります。それぞれの炭素原子は、2 個の水素原子と単結合でつながります。
したがって炭素原子の周りには、2 個の共有電子対と、1 個の二重結合の電子の塊があります。
この 3 つの電子の塊が反発を避けようとすると、それぞれ 120 度ずつの角度で離れます。

こうして炭素原子の周りの 3 つの原子(炭素原子 1 個と水素原子 2 個)は、原子同士の結合の角度がそれぞれ 120° となります。
次は三重結合の例です。
三重結合をもつ分子にアセチレン C2H2 があります。アセチレンは炭素原子間に三重結合があり、そのほか 2 個の水素原子が結合しています。
炭素原子を中心に、水素原子との間に 1 組の共有電子対があり、炭素原子との間に三重結合の電子の塊があります。
したがって炭素原子の周りには、1 個の共有電子対と、1 個の三重結合の電子の塊があります。
この 2 つの電子の塊が反発を避けようとすると、正反対の位置(180 度の角度)になります。

このように三重結合をもつアセチレン分子は、4 つの原子が一直線に並んだ、直線形となります。
問題演習
確認テスト1
次の分子の構造式と電子式を書き、分子の形を考えましょう。
- メタン CH4
- アンモニア NH3
- 水 H2O
- アセチレン C2H2
実践問題1(2019追第1問問4)
水、アンモニアおよびメタンの分子の形の組合せとして最も適当なものを、次の①~⑧のうちから一つ選べ。

(2019年度センター試験 追試験 化学基礎 第1問問4 より引用)
実践問題2(2017本第1問問4)
分子が直線形であるものを、次の①~④のうちから一つ選べ。
① メタン ② 水 ③ 二酸化炭素 ④ アンモニア
(2017年度センター試験 本試験 化学基礎 第1問問4 より一部を引用)
実践問題3(2015追第1問問6)
分子全体の立体的な形に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① 塩化水素は、直線形である。
② 水は、折れ線形である。
③ アンモニアは、正三角形である。
④ メタンは、正四面体形である。
⑤ 二酸化炭素は、直線形である。
(2015年度センター試験 追試験 化学基礎 第1問問6 より引用)