6.02 × 1023 という数値をアボガドロ数といいます。
6.02 × 1023 個をひとまとまりとした粒子の集団のことを、1 mol(モル)といいます。
mol を単位として示された量を、物質量といいます。
物質量 1 mol あたり粒子が何個あるかを表す定数が、アボガドロ定数 NA です。
NA = 6.02214076 × 1023 [ mol-1 ] です。
物質 1 mol あたりの質量をモル質量といいます。モル質量の単位は g/mol です。
もくじ
物質量
物質を構成している原子や分子、イオンといった基本の粒子は、非常に小さいです。そこで、これらを考えるときに、あるまとまった個数で扱うと簡単になります。
アボガドロ数と mol(モル)
これからは、原子や分子などの個数を、6.02 × 1023 個ごとにまとめて扱います。
この 6.02 × 1023 という数値をアボガドロ数といいます。(アボガドロは 19 世紀の科学者です。)
6.02 × 1023 個をひとまとまりとした粒子の集団のことを、1 mol(モル)といいます。
例えば、水素原子が 6.02 × 1023 個あるとき、水素原子が 1 mol あるといいます。また水分子が 6.02 × 1023 個あるとき、水が 1 mol あるといいます。
このように、mol を単位として示された量を、物質量といいます。
アボガドロ定数
もともとアボガドロ数は、
「質量数 12 の炭素原子 12C が 12 g となるときの原子の個数」
として定義されていました。
つまり、12C の炭素原子が 6.02 × 1023 個あると、12 g となります。
現在の定義は炭素原子の質量とは切り離されたので、アボガドロ数は単純に 6.02214076 × 1023 と決まっています。
また、物質量 1 mol あたり粒子が何個あるかを表す定数が、アボガドロ定数 NA です。
NA = 6.02214076 × 1023 [ mol-1 ] です。
アボガドロ定数の単位は、1 mol あたり何個かを表すので、mol-1 です。[ / mol ](パーモル)のように分母に mol をおいてもよいでしょう。
アボガドロ定数は、問題を解くときに、
「ただしアボガドロ定数を 6.02 × 1023 mol-1 として計算せよ」
とか
「ただしアボガドロ定数は 6.0 × 1023 /mol とする」
のように書かれています。
物質量の計算
実際に物質量の計算を練習してみましょう。
「水分子が 9.03 × 1023 個あるとき、水の物質量はいくらか。ただしアボガドロ定数を 6.02 × 1023 /mol とする。」

$$水の物質量 [ mol ] = \frac{9.03 × 10^{23}}{6.02 × 10^{23} [/mol]}$$
これより水の物質量は、1.50 mol と求められます。
「水素分子が 3.0 mol あるとき、水素分子は何個あるか。ただしアボガドロ定数を 6.0 × 1023 /mol とする。」

$$水素分子の個数 = 6.0 × 10^{23} [/mol] × 3.0 [mol]$$
これより水素分子の数は、1.8 × 1024 ( = 18 × 1023 )個と計算できます。
モル質量
物質 1 mol あたりの質量をモル質量といいます。モル質量の単位は g/mol です。
アボガドロ数の粒子が集まったとき、その物質の質量が、モル質量の値にグラムをつけたものに等しくなります。
例えば、質量数 12 の 炭素原子 12C のモル質量は 12 g/mol なので、この 12C が 1 mol あったときその質量は 12 g となります。
ところで、質量数 12 の炭素原子 12C 1 個の質量を 12 と定めて、他の原子の相対質量や原子量を決めていました。また、原子量をもとに分子量を求めることができました。
12C のモル質量が 12 g/mol となるので、他の原子や分子についても、原子量や分子量からモル質量を考えることができます。
相対質量が 12 の 12C 原子が 1 mol まとまったとき、質量は 12 g で、モル質量は 12 g/mol でした。
他の原子や分子も、12C 原子の相対質量との比であらわされているので、同じように考えることができます。
原子量が 1.0 の水素原子 H が 1 mol あったとき、モル質量は 1.0 g/mol であり、この水素原子の質量は 1.0 g です。
原子量が 16 の酸素原子 O が 1 mol あったとき、モル質量は 16 g/mol であり、この酸素原子の質量は 16 g です。
分子量が 18 の水分子 H2O が 1 mol あったとき、モル質量は 18 g/mol であり、この水の質量は 18 g です。
分子量が 44 の二酸化炭素分子 CO2 が 1 mol あったとき、モル質量は 44 g/mol であり、この二酸化炭素の質量は 44 g です。
現在、アボガドロ数の定義は炭素原子の質量とは無関係になりましたが、以前と数値はほぼ変わっていないので、実質的にはこの定義の変更は無視できます。
ですから、物質のモル質量は、その物質の原子量や分子量、式量に単位の [ g/mol ] をつけたもの、と覚えておいてよいでしょう。
モル質量の計算
実際にモル質量の計算を練習してみましょう。
「水が 2.0 mol あるとき、水の質量はいくらか。ただし原子量は H = 1 、O = 16 とする。」
水 H2O の分子量は、水素原子 2 個と酸素原子 1 個の原子量の和なので
1 × 2 + 16 × 1 = 18
となります。したがって水のモル質量は 18 g/mol です。
水 2.0 mol の質量は、モル質量 × 物質量ですから
18 [g/mol] × 2.0 [mol] = 36 [g]
水の質量は 36 g となります。
「メタン CH4 が 32 g あるとき、このメタンの物質量はいくらか。ただし原子量は H = 1 、C = 12 とする。」
メタンの分子量は、炭素原子 1 個と水素原子 4 個の原子量の総和なので、
12 × 1 + 1 × 4 = 16
となります。したがってメタンのモル質量は 16 g/mol です。
メタンは 1 mol あたり 16 g であり、ここではメタンが 32 g あるので、メタンの物質量は
$$\frac{32 [g]}{16 [g/mol]} = 2 [mol]$$
となり、2 mol です。
問題演習
確認テスト1
- 水素原子が 6.02 × 1023 個あるとき、水素原子は A mol です。
- 水分子が 9.03 × 1023 個あるとき、水は B mol です。
- 水素分子が 3.00 mol あるとき、水素分子は C 個あります。
A、B、C に入る、小数点以下第 2 位までの適切な数値を計算しましょう。ただし、アボガドロ定数を 6.02 × 1023 /mol とします。
確認テスト2
- 水分子 H2O の分子量は A なので、モル質量は B g/mol となります。水が 2.0 mol あるとき、水の質量は C g です。ただし原子量は H = 1 、O = 16 とします。
- 分子量が D の二酸化炭素分子 CO2 のモル質量は E g/mol です。ただし原子量は C = 12、O = 16 とします。
- メタン CH4 が 32 g あるとき、このメタンの物質量は F モルです。ただし原子量は H = 1 、C = 12 とします。
A ~ F までに入る適切な数値を計算しましょう。
実践問題1(2018追第2問問2)
純粋なエタノール 9.2 g 中に含まれる分子数はいくつか。最も適当な数値を、次の①~⑥のうちから一つ選べ。ただし、アボガドロ定数を 6.0 × 1023 /mol とする。
必要があれば、原子量は次の値を使うこと。
H 1.0 C 12 O 16
① 1.2 × 1023 ② 1.7 × 1023 ③ 2.1 × 1024
④ 3.0 × 1024 ⑤ 1.8 × 1026 ⑥ 2.5 × 1026
(①~⑥の数値の単位は個)
(2018年度センター試験 追試験 化学基礎 第2問問2 より引用)
実践問題2(2016本第2問問1)
1.0 カラットのダイヤモンドに含まれる炭素原子の物質量として最も適当な数値を、次の①~⑥のうちから一つ選べ。ただし、カラットは質量の単位で、1.0 カラットは 0.20 g である。
必要があれば、原子量は次の値を使うこと。
C 12
① 0.0017 mol ② 0.0024 mol ③ 0.017 mol
④ 0.024 mol ⑤ 0.17 mol ⑥ 0.24 mol
(2016年度センター試験 本試験 化学基礎 第2問問1 より引用)
実践問題3(2018本第1問問4)
原子 X および Z からなり、化学式が X2Z3 で表される物質がある。X および Z のモル質量がそれぞれ Mx [ g/mol ] および Mz [ g/mol ] であるとき、物質 X2Z3 5 g に含まれている X の質量を求める式として正しいものを、次の①~⑥のうちから一つ選べ。
(①~⑥の式の単位は g )

(2018年度センター試験 本試験 化学基礎 第1問問4 より引用)
実践問題4(2018本第2問問1)
180 g の水に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。ただし、アボガドロ数( 6.02 × 1023 )を N とする。
必要があれば、原子量は次の値を使うこと。
H 1.0 O 16
① 水素原子の数は、10 N である。
② 原子核の数は、30 N である。
③ 共有結合に使われている電子の数は、40 N である。
④ 非共有電子対の数は、20 N である。
(2018年度センター試験 本試験 化学基礎 第2問問1 より引用)
実践問題5(2017本第2問問2)
物質 A は、図 1 に示すように、棒状の分子が水面に直立してすき間なく並び、一層の膜(単分子膜)を形成する。物質 A の質量が w [ g ] のとき、この膜の全体の面積は X [ cm2 ] であった。物質 A のモル質量を M [ g/mol ] 、アボガドロ定数を NA [ /mol ] としたとき、分子 1 個の断面積 s [ cm2 ] を表す式として正しいものを、下の①~⑥のうちから一つ選べ。
(①~⑥の式の単位は cm2 )
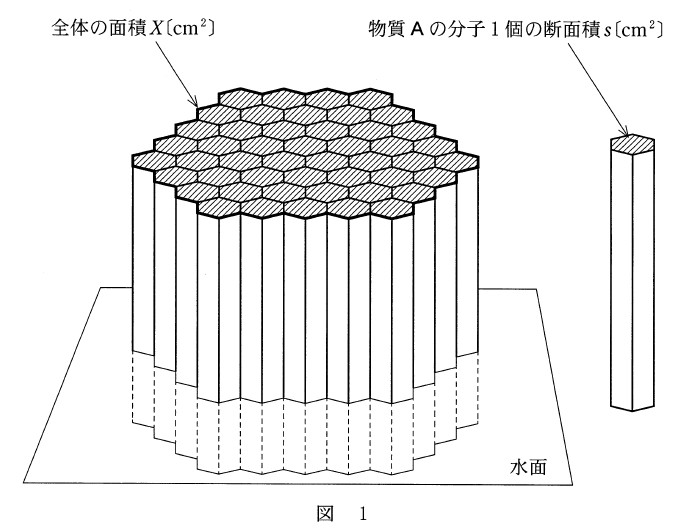

(2017年度センター試験 本試験 化学基礎 第2問問2 より引用)
実践問題6(2017追第2問問1)
物質 1 g 中に含まれる酸素の質量が最も小さいものはどれか。次の①~④のうちから一つ選べ。
必要があれば、原子量は次の値を使うこと。
H 1.0 C 12 N 14 O 16 Si 28
① 二酸化ケイ素 ② 水
③ 二酸化炭素 ④ 一酸化二窒素
(2017年度センター試験 追試験 化学基礎 第2問問1 より引用)
実践問題7(2017追第2問問2)
分子量 M の物質 1 g 中の分子の個数を N としたとき、分子量 18 の物質 100 g 中にある分子の個数を表す式として最も適当なものを、次の①~⑥のうちから一つ選べ。

(2017年度センター試験 追試験 化学基礎 第2問問2 より引用)
実践問題8(2018試第1問問1)
生理食塩水は、塩化ナトリウムを水に溶かしたもので、ヒトの体液と塩分濃度がほぼ等しい水溶液であり、 10 mL の生理食塩水にはナトリウムイオンが 35 mg 含まれている。
1.0 L の生理食塩水に含まれるナトリウムイオンの物質量は何 mol か。最も適当な数値を、次の①~④のうちから一つ選べ。
(①~④の数値の単位は mol )
① 0.060 ② 0.10 ③ 0.15 ④ 0.35
必要があれば、原子量は次の値を使うこと。
Na 23
(第2回 共通テスト試行調査 化学基礎 第1問問1 より一部を引用)
