一般に酸は、酸味があり、青いリトマス紙を赤く変え、亜鉛などの金属と反応し水素を発生させます。
一般に塩基は、苦味があり、赤いリトマス紙を青く変え、酸と反応して酸の性質を打ち消します。
アレーニウスは、水溶液中で水素イオン H+ を生じさせる物質を酸、水酸化物イオン OH- を生じさせる物質を塩基、と定義しました。
ブレンステッドとローリーは、水素イオン H+ を相手に与える物質を酸、水素イオン H+ を相手から受け取る物質を塩基、と定義しました。
もくじ
酸と塩基
塩化水素(塩酸) HCl や硝酸 HNO3 、硫酸 H2SO4 、酢酸 CH3COOH 、炭酸 H2CO3 などは酸と呼ばれる物質です。
(塩化水素が水に溶けた水溶液のことを、塩酸といいます。)
酸の一般的な特徴は、酸っぱい味がして、青いリトマス紙を赤く変色させます。また、マグネシウム Mg やアルミニウム Al 、亜鉛 Zn などの金属と反応して、水素 H2 を発生させます。
これに対し、水酸化ナトリウム NaOH や水酸化カリウム KOH 、水酸化カルシウム Ca(OH)2 、アンモニア NH3 などは塩基と呼ばれる物質です。
なお、アルカリやアルカリ性といわれる物質は、塩基にあたります。アルカリとは、水に溶ける塩基のことです。アルカリやアルカリ性のことを、これからは塩基や塩基性として考えましょう。
塩基の一般的な特徴は、苦い味がして、赤いリトマス紙を青く変色させます。また酸と反応して、酸の性質を打ち消します。
アレーニウスの酸・塩基の定義
19 世紀から 20 世紀にかけて活躍した科学者アレーニウス(アレニウスとも書きます)は、酸と塩基について次のように定義しました。
「水溶液中で電離して水素イオン H+ を生じさせる物質を酸、水溶液中で電離して水酸化物イオン OH- を生じさせる物質を塩基とする。」
塩酸や硫酸といった酸や、水酸化ナトリウムや水酸化カルシウムといった塩基は、水溶液中で電離してイオンになります。このとき、アレーニウスの定義の通り、酸からは水素イオンが、塩基からは水酸化物イオンが生じます。
塩化水素 1 分子からは水素イオン H+ が 1 個、硫酸 1 分子からは水素イオン H+ が 2 個生じています。
水酸化ナトリウムからは水酸化物イオン OH- が 1 個、水酸化カルシウムからは水酸化物イオン OH- が 2 個生じています。
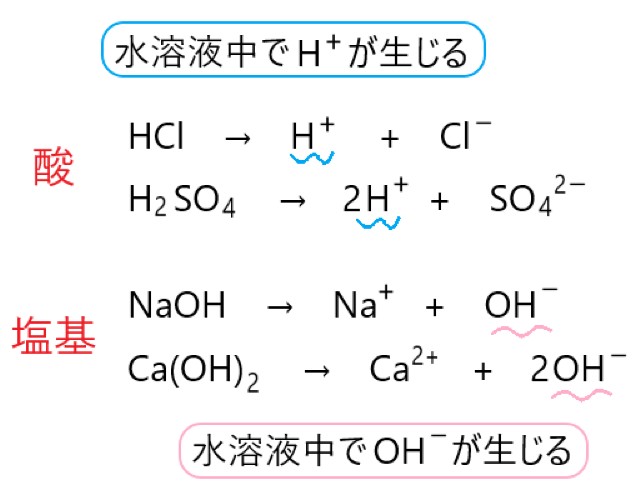
ブレンステッド・ローリーの酸・塩基の定義
アレーニウスの定義では、物質を水に溶かした水溶液の状態でしか、酸と塩基について考えることができません。
水溶液以外でも酸と塩基について考えたいので、20 世紀に活躍した科学者ブレンステッドとローリーが、さらに範囲を広くとって酸と塩基を定義しました。
「水素イオン H+ を他の物質に与える物質を酸、水素イオン H+ を他の物質から受け取る物質を塩基とする。」
ブレンステッド・ローリーの定義によって、水酸化物イオンに相当する原子団をもたないアンモニアのような物質も、塩基として考えることができます。
アンモニアが水に溶けると、水から水素イオン H+ を 1 個受け取り、アンモニウムイオン NH4+ となります。
また水がない状態でも、酸と塩基の反応について考えることができます。
濃アンモニア水と塩酸を近づけると、気体のアンモニア分子と気体の塩化水素分子が反応し、塩化アンモニウム NH4Cl の固体が生成し、白煙として観察できます。
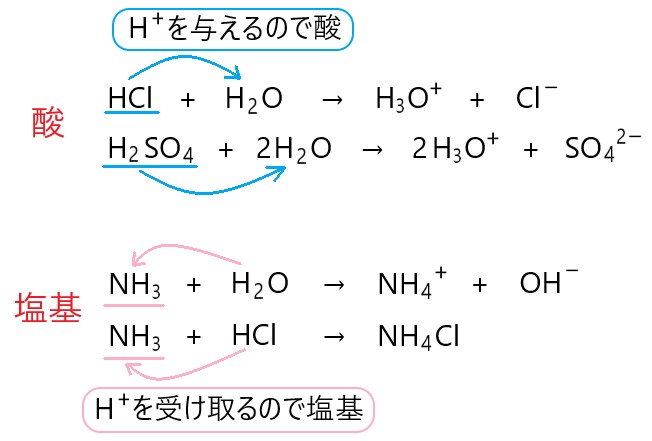
アレーニウスの定義では、水溶液中で酸が水素イオン H+ を生じさせます。
実際はこの H+ は単独で存在せず、水溶液中では水分子と配位結合して、オキソニウムイオン H3O+ となっています。
ですから、アレーニウスの酸でも実際はオキソニウムイオンが生成しており、ブレンステッド・ローリーの酸でオキソニウムイオンが生じるのと同じ結果になっています。

酸にも塩基にもなる物質
ブレンステッド・ローリーの定義に従うと、水などの物質は、酸にも塩基にもなります。
塩酸や硫酸が相手になると、水は塩基として振る舞います。アンモニアが相手なら、水は酸となります。
ブレンステッド・ローリーの定義では、酸と塩基は水素イオンを与えるか受け取るかで決まります。つまり相手の物質との関係で決まる、相対的な概念といえます。

問題演習
確認テスト1
代表的な酸と塩基を示した表を完成させましょう。
| 酸 | 化学式 | 塩基 | 化学式 |
| 塩化水素 | HCl | 水酸化ナトリウム | NaOH |
| 硝酸 | KOH | ||
| CH3COOH | アンモニア | ||
| 硫酸 | 水酸化カルシウム | ||
| 炭酸 |
確認テスト2
アレーニウスの定義に従って、以下の化学反応式の物質を酸と塩基に分類しましょう。
1. NaOH → Na+ + OH-
2. HCl → H+ + Clー
3. H2SO4 → 2 H+ + SO42-
4. Ca(OH)2 → Ca2+ + 2 OH-
確認テスト3
ブレンステッド・ローリーの定義によれば、赤字の化合物は酸と塩基のどちらになるか、考えましょう。
1. NH3 + HCl → NH4Cl (NH4+ と Cl- のイオン結晶)
2. HCl + H2O → H3O+ + Clー
3. H2SO4 + 2 H2O → 2 H3O+ + SO42-
4. NH3 + H2O → NH4+ + OH-
実践問題1(2018追第2問問3)
次の反応ア~オのうち、水が酸としてはたらいている反応はどれか。正しく選択しているものを、下の①~⑤のうちから一つ選べ。
ア HCl + H2O → H3O+ + Cl-
イ HNO3 + H2O → H3O+ + NO3-
ウ CH3COO- + H2O ⇄ CH3COOH + OH-
エ CH3COOH + H2O ⇄ H3O+ + CH3COO-
オ CO32- + H2O ⇄ HCO3- + OH-
① ア、イ ② ウ、オ ③ エ、オ
④ ア、イ、エ ⑤ ウ、エ、オ
(2018年度センター試験 追試験 化学基礎 第2問問3 より引用)
実践問題2(2015本第2問問4)
次の反応Ⅰおよび反応Ⅱで、下線を付した分子およびイオン( a ~ d )のうち、酸としてはたらくものの組合せとして最も適当なものを、下の①~⑥のうちから一つ選べ。
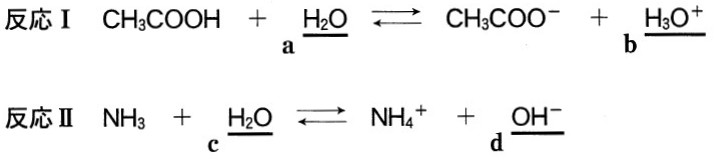
① a と b ② a と c ③ a と d
④ b と c ⑤ b と d ⑥ c と d
(2015年度センター試験 本試験 化学基礎 第2問問4 より引用)
