溶液中で物質がどのくらい電離しているかを割合として示す値を、電離度といいます。
$$電離度 α = \frac{電離した酸(塩基)の物質量[mol]}{溶かした酸(塩基)の全物質量[mol]}$$
電離度がほぼ 1 に近い酸のことを、強酸といいます。
一方ほとんど電離せず、電離度が 1 より非常に小さい酸のことを、弱酸といいます。
塩基も同様に、電離度がほぼ 1 である塩基のことを強塩基、電離度が 1 より非常に小さい塩基のことを弱塩基といいます。
もくじ
強酸・弱酸および強塩基・弱塩基
酸を分類するのに、強酸と弱酸という考え方があります。
強酸には、塩酸 HCl や硝酸 HNO3 、硫酸 H2SO4 などがあてはまります。他のほとんどの酸は弱酸で、酢酸 CH3COOH や炭酸 H2CO3 などがあります。
塩酸や硝酸、硫酸は、強い酸というイメージの通りでしょう。一方の酢酸は食品に含まれるお酢の成分であり、炭酸も炭酸水のことを考えれば、弱い酸というイメージが適切です。
同様に塩基も、強塩基と弱塩基に分けて考えられます。
強塩基には水酸化ナトリウム NaOH や水酸化カリウム KOH 、水酸化カルシウム Ca(OH)2 などがあります。ただし、ほとんどの塩基は弱塩基になります。アンモニア NH3 は弱塩基です。
ところで、強酸と弱酸、強塩基と弱塩基は、何となく分類されているわけではありません。物質が水溶液中でどのように電離しているかによって、これらは分けられています。
電離度
水溶液中で物質がどのくらい電離しているかを割合として示す値を、電離度といいます。電離度は α(アルファ)として表されることが多いです。
酸(または塩基)の電離度 α は、次のように表されます。
$$電離度 α = \frac{電離した酸(塩基)の物質量[mol]}{溶かした酸(塩基)の全物質量[mol]}$$
電離度は、溶解した全物質量のうち、どれだけ電離しているかを比で表しているので、α の値は 0 から 1 のあいだ( 0 < α ≦ 1 )になります。
塩酸の電離度
例えば、塩化水素 HCl を 1 mol 準備して、1000 L の水に溶かして水溶液とします。このとき、0.99 mol の HCl が電離しているとすると、電離度は 0.99 になります。
$$α = \frac{0.99[mol]}{1[mol]} = 0.99$$
これは電離度が 0.99 ならば、水に 100 個の HCl 分子を入れたら、水溶液中に 99 個の H+ と 99個の Cl- 、さらに 1 個の HCl が存在しています。

つまり 1 mol の塩化水素を水に投入すると、0.99 mol が電離して 0.99 mol の水素イオンと 0.99 mol の塩化物イオンになり、0.01 mol の塩化水素が残っていることを意味します。

酢酸の電離度
その他の例として、1 mol の酢酸を 1 L の水に溶かした場合を考えます。このとき、0.01 mol の酢酸が電離しているとすると、電離度は 0.01 になります。
$$α = \frac{0.01[mol]}{1[mol]} = 0.01$$
酢酸が水の中で電離する化学反応式は、次のようになります。
CH3COOH → CH3COO- + H+

塩基の電離度
塩基の電離度についても、酸と同じように考えられます。
例えば水酸化ナトリウム NaOH を水に溶かしたとき、溶かした全物質量と溶解した物質量の比から、電離度が求められます。
NaOH を 1 mol 準備し、これを 10 L の水に溶かしたとき、0.99 mol の NaOH が電離したとすると、電離度は 0.99 です。
$$α = \frac{0.99[mol]}{1[mol]} = 0.99$$
NaOH が電離するときの化学反応式は次の通りなので
NaOH → Na+ + OH-
NaOH 1 mol を水に溶かしたとき、仮に電離度が 0.99 ならば、水溶液中にはナトリウムイオン Na+ が 0.99 mol 、水酸化物イオン OH- が 0.99 mol 存在し、電離していない NaOH が 0.01 mol 残っています。
電離度と酸・塩基の強弱
物質によって電離度は大きく異なります。塩酸のように電離度がほぼ 1 となる酸もあれば、酢酸のように電離度がとても小さく 0 に近い値をとる酸もあります。
電離度がほぼ 1 に近く、水に溶けるとほとんど電離し水素イオンを生じる酸のことを、強酸といいます。
一方、水に溶けてもほとんど電離せず、電離度が 1 より非常に小さい酸のことを、弱酸といいます。
塩基についても同様に、電離度がほぼ 1 に近く、水に溶けるとほとんど電離し水酸化物イオンを生じる(あるいは水素イオンを受け取る)塩基のことを、強塩基といいます。
一方、水に溶けてもほとんど電離せず、電離度が 1 より非常に小さい塩基のことを、弱塩基といいます。
強塩基となるのは、アルカリ金属(カリウム K やナトリウム Na )と、アルカリ土類金属(カルシウム Ca やバリウム Ba )の水酸化物です。その他の塩基は弱塩基です。
代表的な酸・塩基のまとめ
ここまでの学習で、酸・塩基について、価数と強弱から分類することができます。代表的な酸と塩基を表にまとめました。
| 強酸 | 弱酸 | |
| 1価 | 塩化水素(塩酸) HCl 硝酸 HNO3 | 酢酸 CH3COOH |
| 2価 | 硫酸 H2SO4 | シュウ酸 (COOH)2 炭酸 H2CO3 硫化水素 H2S |
| 3価 | リン酸 H3PO4 |
| 強塩基 | 弱塩基 | |
| 1価 | 水酸化ナトリウム NaOH 水酸化カリウム KOH | アンモニア NH3 |
| 2価 | 水酸化カルシウム Ca(OH)2 水酸化バリウム Ba(OH)2 | 水酸化マグネシウム Mg(OH)2 水酸化銅(Ⅱ) Cu(OH)2 水酸化鉄(Ⅱ) Fe(OH)2 |
| 3価 | 水酸化アルミニウム Al(OH)3 水酸化鉄(Ⅲ) Fe(OH)3 |
問題演習
確認テスト1
0.1 モルの硝酸 HNO3 を水に溶かしたら、0.09 モルの硝酸が電離しました。この水溶液の電離度はいくつですか。
確認テスト2
0.2 モルの酢酸 CH3COOH を水に溶かしたとき、電離度は 0.01 でした。水溶液中に電離している酢酸の物質量はいくらですか。
確認テスト3
例にならって、空欄を埋めましょう。
例:塩酸 ( ) ( )価の( ) 解答:HCl 1 価の強酸
- リン酸
- 水酸化ナトリウム
- 硫酸
- アンモニア
- 水酸化バリウム
- 硝酸
- 水酸化カリウム
- 酢酸
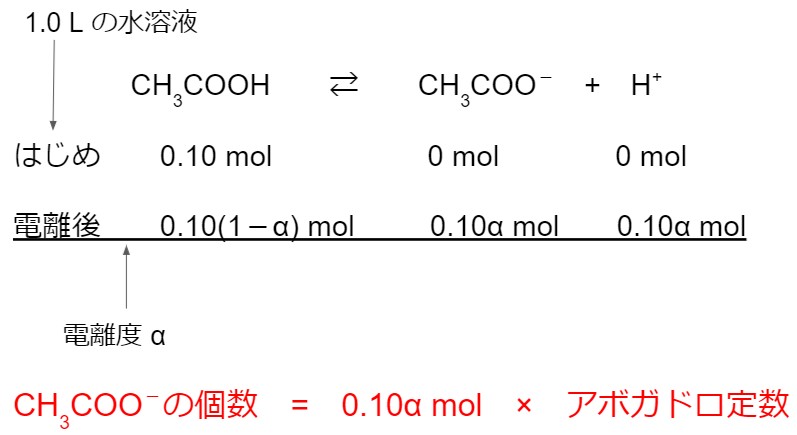
実践問題1(2019追第2問問3)
0.10 mol/L の酢酸水溶液 1.0 L には、電離してできた酢酸イオンが何個あるか。最も適当な数値を、次の①~⑥のうちから一つ選べ。ただし、この水溶液中の酢酸の電離度は 1.6 × 10-2 、アボガドロ定数は 6.0 × 1023 /mol とする。
① 4.8 × 1020 個 ② 9.6 × 1020 個 ③ 1.9 × 1021 個
④ 4.8 × 1021 個 ⑤ 9.6 × 1021 個 ③ 5.9 × 1022 個
(2019年度センター試験 追試験 化学基礎 第2問問3 より引用)