化学反応式のうち、反応とは無関係のイオンを省略した反応式を、特にイオン反応式といいます。
酸の水素イオン H+ と塩基の水酸化物イオン OH- が反応し、酸と塩基の性質を打ち消して、水 H2O が生成することを中和反応といいます。
中和反応で、酸の陰イオンと塩基の陽イオンから生成した物質を、塩(えん)といいます。
もくじ
イオン反応式
化学反応式のうち、電離した各物質をイオン式で表し、さらに反応とは無関係のイオンを省略した反応式を、イオン反応式といいます。
例として、硝酸銀 AgNO3 水溶液に塩化ナトリウム NaCl 水溶液を混合した反応を考えます。
化学反応式は、以下のようになります。
AgNO3 + NaCl → AgCl + NaNO3
硝酸銀と塩化ナトリウムが反応し、溶液中で白色の塩化銀 AgCl が沈殿し、硝酸ナトリウム NaNO3 が生成します。
ただしこの反応では、沈殿した AgCl 以外の物質は、すべて水溶液中で電離しています。そこではじめの化学反応式をイオン式を用いて表すと、
Ag+ + NO3- + Na+ + Cl- → AgCl + Na+ + NO3-
このとき、両辺でナトリウムイオン Na+ と硝酸イオン NO3- は反応に関与せず、そのまま残っています。
そこでこれらの反応に無関係なイオンを省略し、反応に関わったイオンだけで反応式をつくると、イオン反応式ができます。
Ag+ + Cl- → AgCl
またイオン反応式では、左辺の電荷の和と右辺の電荷の和が等しくなります。

中和反応
酸の水素イオン H+ と塩基の水酸化物イオン OH- が反応し、酸と塩基の性質を打ち消して、水 H2O が生成することを中和反応といいます。
中和反応で、酸の陰イオンと塩基の陽イオンから生成した物質を、塩(えん)といいます。
例えば、酸である塩酸 HCl と、塩基である水酸化ナトリウム NaOH 水溶液が混ざると、中和反応が起こります。
HCl + NaOH → NaCl + H2O
中和反応により、塩である塩化ナトリウム NaCl と水 H2O が生成します。
もう少し詳しく見ると、塩酸と水酸化ナトリウムはともに水溶液中で電離していて、反応後もナトリウムイオン Na+ と塩化物イオン Cl- は電離しているので、
H+ + Cl- + Na+ + OH- → Na+ + Cl- + H2O
という化学反応式になり、中和反応は実質的に水が生成する反応です。
H+ + OH- → H2O
ただし、Na+ と Cl- はまとめて NaCl のように塩とします。

中和反応の例
中和反応では、酸がもつ水素イオン H+ と、塩基がもつ水酸化物イオン OH- がすべて反応して水になると、反応が終了します。
中和反応の例をいくつか見ておきましょう。
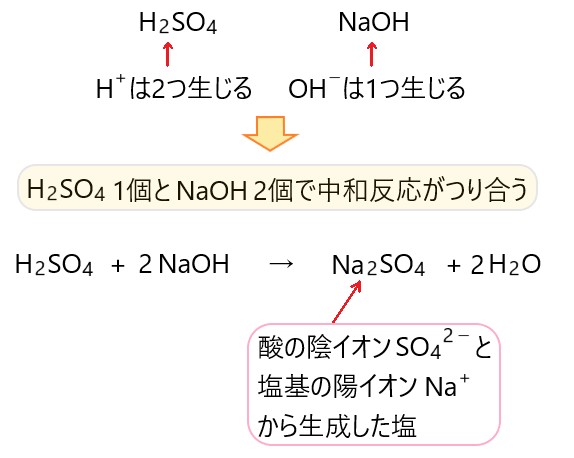
硫酸 H2SO4 と水酸化ナトリウム NaOH 水溶液の中和反応
中和反応で水が生成して、さらに酸の陰イオンと塩基の陽イオンから塩が生成するので、以下のような化学反応式になります。
H2SO4 + NaOH → Na2SO4 + H2O
左辺と右辺の原子の数が合うように係数をつけると、下のような中和反応となります。
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
2 価の酸である H2SO4 からは H+ が 2 個生じ、1 価の塩基である NaOH からは OH- が 1 個生じることから、化学反応式の係数を考えてもよいでしょう。
塩酸 HCl と水酸化カルシウム Ca(OH)2 水溶液の中和反応
塩酸は 1 価の酸なので、水溶液中では HCl からは 1 個の H+ が生じます。水酸化カルシウムは 2 価の塩基なので、Ca(OH)2 からは 2 個の OH- が生じます。
そこで中和反応は、 HCl が 2 つと Ca(OH)2 が 1 つでつり合います。
2 HCl + Ca(OH)2 → CaCl2 + 2 H2O
詳しく見ると、水溶液中では HCl も Ca(OH)2 も電離しているので、水が生成する中和反応は
2 H+ + 2 OH- → 2 H2O
酸の陰イオン Cl- と塩基の陽イオン Ca2+ から塩が生成する反応は
2 Cl- + Ca2+ → CaCl2
となっています。

問題演習
確認テスト1
次の中和反応の化学反応式を書きましょう。
1. 塩酸と水酸化ナトリウム
2. 硫酸と水酸化ナトリウム
3. 塩酸と水酸化カルシウム
4. 酢酸と水酸化ナトリウム
