中和反応では、酸の陰イオンと塩基の陽イオンから、塩が生成します。
塩の化学式のなかに、酸の H が残っているものを酸性塩、塩基の OH が残っているものを塩基性塩、どちらもないものを正塩といいます。
強酸と強塩基から生じた塩を水に溶かすと、中性を示します。
強酸と弱塩基から生じた塩を水に溶かすと、酸性を示します。
弱酸と強塩基から生じた塩を水に溶かすと、塩基性を示します。
弱酸の塩の水溶液に強酸を加えると、弱酸が遊離します。
弱塩基の塩の水溶液に強塩基を加えると、強塩基が遊離します。
もくじ
塩の分類
中和反応では、酸の陰イオンと塩基の陽イオンから、塩が生成します。
この塩の化学式のなかに、酸の H が残っているものを酸性塩といいます。
例えば、炭酸 H2CO3 と水酸化ナトリウム NaOH が反応したとき、炭酸水素ナトリウム NaHCO3 が塩として生成します。
H2CO3 + NaOH → NaHCO3 + H2O
炭酸水素ナトリウム NaHCO3 の化学式のなかには、酸から残った H があるので、これは酸性塩です。
塩の化学式のなかに、塩基の OH が残っているものを塩基性塩といいます。
例えば、塩酸 HCl と水酸化カルシウム Ca(OH)2 が反応したとき、塩化水酸化カルシウム CaCl(OH) が塩として生成します。
HCl + Ca(OH)2 → CaCl(OH) + H2O
塩化水酸化カルシウム CaCl(OH) の化学式のなかには、塩基から残った OH があるので、これは塩基性塩です。
塩の化学式のなかに、H も OH もないものを正塩といいます。
例えば、塩酸 HCl と水酸化ナトリウム NaOH が反応したとき、塩化ナトリウム NaCl が塩として生成します。
HCl + NaOH → NaCl + H2O
塩化ナトリウム NaCl の化学式のなかには、H も OH も残っていないので、これは正塩です。
酸性塩・塩基性塩・正塩の例
| 酸性塩 | NaHCO3 NaHSO4 |
| 塩基性塩 | CaCl(OH) MgCl(OH) |
| 正塩 | NaCl Na2CO3 KNO3 NH4Cl |
塩は酸性塩、塩基性塩、正塩と分類できますが、これは形式的であり、あまり実用性はありません。
酸性塩を水に溶かすと酸性になりそうですが、そうとは限りません。酸性になることもありますし、塩基性になることもあります。
これは塩基性塩、正塩も同じです。水に溶かしたら液性はどうなるのかは、次項で説明するように、塩を構成する物質で決まります。
塩の水溶液
液性
中和反応で生成する塩を水に溶かすとき、液性は塩によって決まります。
基本的には、強酸と強塩基から生じた塩を水に溶かすと中性、強酸と弱塩基から生じた塩を水に溶かすと酸性、弱酸と強塩基から生じた塩を水に溶かすと塩基性を示します。

強酸と強塩基の塩の例では、塩酸 HCl と水酸化ナトリウム NaOH から生成する塩化ナトリウム NaCl があげられます。
NaCl を水に溶かすと H+ も OH- も発生しないので、液性は中性です。食塩水が中性であることを思い出すとよいでしょう。
強酸と弱塩基の塩の例では、塩酸 HCl とアンモニア NH3 から生成する塩の塩化アンモニウム NH4Cl があります。
NH4Cl を水に溶かすと、この水溶液は酸性になります。
弱酸と強塩基の塩の例では、酢酸 CH3COOH と水酸化ナトリウム NaOH から生成する塩の酢酸ナトリウム CH3COONa があります。
CH3COONa を水に溶かすと、この水溶液は塩基性になります。
注意すべき塩(1)
上記の基本的な考え方で、塩の水溶液の液性はだいたいわかります。ただし注意が必要な場合があります。
例えば、強酸と強塩基から生成する塩でも、中和反応が完全に終わっていない場合は中性になりません。
硫酸と水酸化ナトリウムが反応し、以下のような化学反応式となっているとき、
H2SO4 + NaOH → NaHSO4 + H2O
ここで生じた硫酸水素ナトリウム NaHSO4 は、強酸と強塩基の塩ですが、NaHSO4 の水溶液は酸性となります。
中和反応がまだ途中なので、その塩には酸から残った H があり、酸性となります。
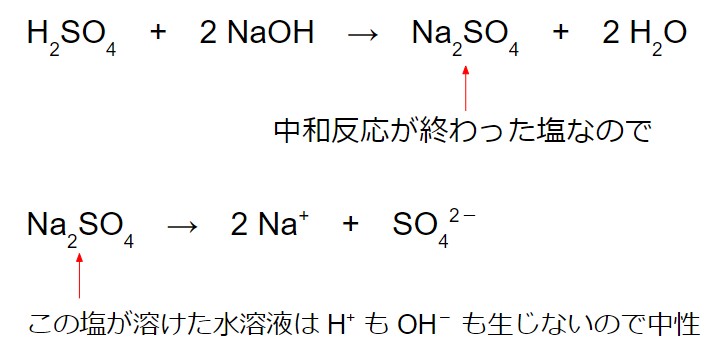
硫酸は 2 価の強酸であり、水酸化ナトリウムは 1 価の強塩基です。中和反応が完全に終わるとき、次のような化学反応式で表されます。
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
ここで得られる塩の硫酸ナトリウム Na2SO4 は、水に溶かすと中性になります。

注意すべき塩(2)
炭酸 H2CO3 と水酸化ナトリウム NaOH から生成する塩も、注意しましょう。
まず、炭酸ナトリウム Na2CO3 を考えます。炭酸は弱酸であり、水酸化ナトリウムは強塩基です。
基本の考え方の通り、Na2CO3 を水に溶かすと塩基性を示します。
次に、炭酸水素ナトリウム NaHCO3 を考えます。こちらは少し注意しましょう。
この化学式には酸から残った H があるので、NaHCO3 を水に溶かすと酸性になりそうな気がします。しかし実際の水溶液は、弱い塩基性となります。
NaHCO3 を水に溶かすと、下のような反応が起こります。
NaHCO3 + H2O → Na+ + H2CO3 + OH-
塩を水に溶かすと OH- が生じるので、水溶液は少し塩基性になります。

このあたりの内容は難しいので、「化学基礎」ではなく「化学」で学習します。もう少し進んだら学ぶことになるでしょう。
Na2CO3 や NaHCO3 は、弱酸である炭酸と強塩基である水酸化ナトリウムの塩です。今の段階では、弱酸と強塩基の塩なので水溶液は塩基性だ、と簡単に考えましょう。
弱酸・弱塩基の遊離反応
弱酸の遊離反応
弱酸から生成した塩の水溶液に強酸を加えると、強酸の塩が生じて、弱酸が遊離します。
弱酸の塩 + 強酸 → 弱酸 + 強酸の塩
例えば、弱酸の塩である酢酸ナトリウム CH3COONa に、強酸である塩酸 HCl を加えると、強酸の塩である塩化ナトリウム NaCl が生じます。
そのかわりに、弱酸である酢酸 CH3COOH が生成します。
CH3COONa + HCl → CH3COOH + NaCl
この理由は、酢酸は弱酸で電離度が小さいため、水溶液中の H+ が多くなると、酢酸イオン CH3COO- が酢酸 CH3COOH に戻りやすくなるためです。
塩が水に溶けた段階では、水溶液中で酢酸イオン CH3COO- とナトリウムイオン Na+ に電離しています。
CH3COONa → CH3COO- + Na+
この水溶液に強酸の塩酸 HCl を加えると、水溶液中に大量の H+ と Cl- が電離します。
酢酸は電離度が小さく、酢酸イオンより酢酸分子の状態で多く存在します。大量に H+ が加えられたことで、酢酸イオンが酢酸に変わりやすくなり、酢酸が遊離します。
CH3COO- + H+ → CH3COOH
一方、水溶液に残った Na+ と Cl- から、強酸の塩が生成します。
Na+ + Cl- → NaCl


弱塩基の遊離反応
同じような反応は、弱塩基の塩でも起こります。
弱塩基から生成した塩の水溶液に強塩基を加えると、強塩基の塩が生じて、弱塩基が遊離します。
弱塩基の塩 + 強塩基 → 弱塩基 + 強塩基の塩
例えば、弱塩基の塩である塩化アンモニウム NH4Cl に、強塩基である水酸化ナトリウム NaOH を加えると、強塩基の塩である塩化ナトリウム NaCl が生じます。
そのかわりに、弱塩基であるアンモニア NH3 が生成します。
NH4Cl + NaOH → NH3 + H2O + NaCl
この理由は、アンモニアは弱塩基で電離度が小さいため、アンモニウムイオン NH4+ よりアンモニア NH3 になりやすいためです。
塩が水に溶けた段階では、水溶液中でアンモニウムイオン NH4+ と塩化物イオン Cl- に電離しています。
NH4Cl → NH4+ + Cl-
この水溶液に強塩基の水酸化ナトリウム NaOH を加えると、水溶液中に大量の Na+ と OH- が電離します。
アンモニアは電離度が小さく、アンモニウムイオンよりアンモニア分子の状態で多く存在します。
大量に OH- が加えられたことで、アンモニウムイオンがアンモニアに変わりやすくなり、アンモニアが遊離します。
NH4+ + OH- → NH3 + H2O
一方、水溶液に残った Na+ と Cl- から、強塩基の塩が生成します。
Na+ + Cl- → NaCl
問題演習
確認テスト1
次の塩は酸性塩、塩基性塩、正塩のどれに分類されるでしょうか。
- NaHCO3
- CaCl(OH)
- NaCl
- NH4Cl
確認テスト2
次の塩を溶かすと、水溶液の液性はどうなるでしょうか。
- NaCl
- NH4Cl
- CH3COONa
- NaHSO4
- NaHCO3
確認テスト3
酢酸ナトリウム CH3COONa 水溶液に塩酸を加えると、刺激臭がしました。この刺激臭が発生した原因を考えましょう。
確認テスト4
塩化アンモニウム NH4Cl 水溶液に水酸化ナトリウムを加えると、刺激臭がしました。この刺激臭が発生した原因を考えましょう。
実践問題1(2015本第2問問5)
次に示す 0.1 mol/L の水溶液(ア~ウ)を pH の大きい順に並べたものはどれか。最も適当なものを、下の①~⑥のうちから一つ選べ。
ア CH3COONa 水溶液
イ NH4Cl 水溶液
ウ NaCl 水溶液
① ア > イ > ウ ② ア > ウ > イ ③ イ > ア > ウ
④ イ > ウ > ア ⑤ ウ > ア > イ ⑥ ウ > イ > ア
(2015年度センター試験 本試験 化学基礎 第2問問5 より引用)
実践問題2(2020本第2問問4)
次に示す 0.1 mol/L の水溶液ア~ウを pH の大きい順に並べたものはどれか。最も適当なものを、下の①~⑥のうちから一つ選べ。
ア NaCl 水溶液
イ NaHCO3 水溶液
ウ NaHSO4 水溶液
① ア > イ > ウ ② ア > ウ > イ ③ イ > ア > ウ
④ イ > ウ > ア ⑤ ウ > ア > イ ⑥ ウ > イ > ア
(2020年度センター試験 本試験 化学基礎 第2問問4 より引用)
実践問題3(2019本第2問問3)
酸 A と塩基 B を過不足なく中和して得られた正塩の水溶液は、塩基性を示した。酸 A と塩基 B の組合せとして正しいものを、次の①~⑤のうちから一つ選べ。

(2019年度センター試験 本試験 化学基礎 第2問問3 より引用)
実践問題4(2016本第2問問5)
次の塩ア~カには、下の記述( a ・ b )に当てはまる塩が二つずつある。その塩の組合せとして最も適当なものを、下の①~⑧のうちから一つずつ選べ。
ア CH3COONa イ KCl ウ Na2CO3
エ NH4Cl オ CaCl2 カ (NH4)2SO4
a 水に溶かしたとき、水溶液が酸性を示すもの
b 水に溶かしたとき、水溶液が塩基性を示すもの
① アとウ ② アとオ ③ イとウ ④ イとエ
⑤ ウとカ ⑥ エとオ ⑦ エとカ ⑧ オとカ
(2016年度センター試験 本試験 化学基礎 第2問問5 より引用)
