確認テスト
問1
赤字の原子の酸化数はいくつでしょうか。
- SO2
- H2O2
- NH4+
- Fe2O3
- Cr2O72-
問2
次の反応で、下線を引いた原子が酸化されていれば A を、還元されていれば B を選びましょう。
1. 2 CO + O2 → 2 CO2
2. 2 H2S + O2 → 2 S + 2H2O
3. 2 H2S + SO2 → 3 S + 2H2O
4. Cu + 4 HNO3 → 2 NO2 + Cu(NO3)2 + 2 H2O
正解を見る
1. A(酸化数は +2 → +4 )
2. A(酸化数は -2 → 0 )
3. B(酸化数は +4 → 0 )
4. A(酸化数は 0 → +2)
問3
次の反応で、赤字の化合物は酸化剤ですか、還元剤ですか。
1. 2 KI + Cl2 → 2 KCl + I2
2. 2 H2S + O2 → 2 S + 2H2O
3. 2 H2S + SO2 → 3 S + 2H2O
4. Cu + 4 HNO3 → 2 NO2 + Cu(NO3)2 + 2 H2O
正解を見る
1. Cl2 の Cl 原子の酸化数を 0 から -1 へと還元させているので、KI は還元剤です。
2. O2 の O 原子の酸化数を 0 から -2 へと還元させているので、H2S は還元剤です。
3. H2S の S 原子の酸化数を -2 から 0 へと酸化させているので、SO2 は酸化剤です。
4. Cu 原子の酸化数は、0 から +2 へと酸化されているので、相手を還元しています。ですから、Cu は還元剤です。
( HNO3 から NO2 に変化した N 原子の酸化数は、+5 から +4 へと還元されています。このことからも、Cu が還元剤であることがわかります。)
問4
硫酸で酸性にした過酸化水素水に、過マンガン酸カリウム水溶液を滴下します。過酸化水素水がすべて反応すると、過マンガン酸カリウム水溶液の赤紫色が消えずに残ります。
このときの過マンガン酸カリウムと過酸化水素の半反応式を書きましょう。
1. KMnO4 は反応して Mn2+ に変化します。KMnO4 の半反応式は?
2. H2O2 は反応して O2 に変化します。H2O2 の半反応式は?
正解を見る
1. 過マンガン酸カリウム KMnO4 が酸化剤としてはたらき、Mn2+ が生成する半反応式を書きましょう。
① 酸化剤の過マンガン酸カリウム KMnO4 は左辺に、発生する Mn2+ は右辺に書きます。K は反応に関与しないので省略します。
MnO4- → Mn2+
② 両辺の酸素原子 O の数を等しくするため、右辺に H2O を 4 個加えます。
MnO4- → Mn2+ + 4 H2O
③ 両辺の水素原子 H の数を等しくするため、左辺に H+ を 8 個加えます。
MnO4- + 8 H+ → Mn2+ + 4 H2O
④ 両辺の電荷をつり合わせるため、左辺に電子 e- を 5 個加えます。
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
これで過マンガン酸カリウム KMnO4 の半反応式が完成しました。
2. 過酸化水素 H2O2 が還元剤としてはたらき、O2 が発生する半反応式を書きましょう。
① 還元剤 H2O2 は左辺、変化して生成する O2 が右辺です。
H2O2 → O2
② 両辺の酸素原子 O の数を比べますが、すでに等しいです。
H2O2 → O2
③ 両辺の水素原子 H の数を等しくするため、右辺に H+ を 2 個加えます。
H2O2 → O2 + 2 H+
④ 両辺の電荷をつり合わせるため、右辺に電子 e- を 2 個加えます。
H2O2 → O2 + 2 H+ + 2 e-
これで過酸化水素 H2O2 (還元剤)の半反応式が完成しました。
問5
問 4 で過マンガン酸カリウムと過酸化水素の半反応式を書きました。
これをもとに、硫酸で酸性にした過酸化水素水に、過マンガン酸カリウム水溶液を滴下したときの酸化還元反応式を考えましょう。
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O ‥‥(A)
H2O2 → O2 + 2 H+ + 2 e- ‥‥(B)
正解を見る
酸化還元反応では、酸化剤が得る電子の数と、還元剤が失う電子の数は等しくなります。そこで、2 つの半反応式で受け渡す電子の数を揃えて、両式を足し合わせることでイオン反応式がつくれます。
(A)式を 2 倍、(B)式を 5 倍して両式を足し合わせると、電子 e- が消去できます。
イオン反応式は以下のようになります。
2 MnO4- + 5 H2O2 + 6 H+ → 2 Mn2+ + 5 O2 + 8 H2O
この水溶液中には K+ イオンと SO42- イオンがあるので、両辺に K+ を 2 個、SO42- を 3 個加えると、電気的に中性な酸化還元反応式ができます。
2 KMnO4 + 5 H2O2 + 3 H2SO4 → 2 MnSO4 + 5 O2 + 8 H2O + K2SO4
問6
金属に関する記述として誤りを含むものを、次の①~⑨のうちから三つ選びましょう。
① ナトリウム Na は、常温で水と反応して水酸化物になり、水素を発生する。
② ナトリウム Na は、乾いた空気中でもすぐに酸化して酸化物となる。
③ アルミニウム Al は、塩酸と反応して水素を発生する。
④ アルミニウム Al は、高温の水蒸気と反応して酸化物になり、水素を発生する。
⑤ アルミニウム Al は、濃硝酸と反応して二酸化窒素を発生する。
⑥ スズ Sn は、高温の水蒸気と反応して酸化物になり、水素を発生する。
⑦ スズ Sn は、希硫酸と反応して水素を発生する。
⑧ 銅 Cu は、塩酸には溶けないが、希硝酸と反応して一酸化窒素を発生する。
⑨ 金 Au は、熱濃硫酸に溶ける。
正解を見る
5、6、9
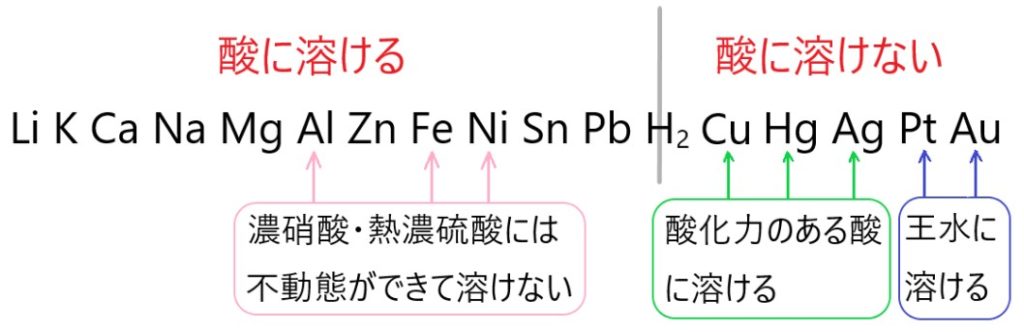
簡単にまとめると、イオン化傾向が大きい金属は酸化されやすいので反応性が高く、イオン化傾向が小さい金属は酸化されにくく反応性に乏しいです。


1 〇 ナトリウムは常温で水と反応し水酸化ナトリウムとなり、水素を発生します。
2 Na + 2 H2O → 2 NaOH + H2
2 〇 ナトリウムは空気中で速やかに酸化されます。
4 Na + O2 → 2 Na2O
3 〇 アルミニウムは塩酸と反応して、水素を発生します。
2 Al + 6 HCl → 2 AlCl3 + 3 H2
4 〇 アルミニウムは高温の水蒸気と反応して、水素を発生します。
2 Al + 3 H2O → Al2O3 + 3 H2
5 × アルミニウムは酸に溶けますが、濃硝酸にふれたときは不動態となるので溶けません。
6 × スズは水とは反応しません。
7 〇 スズは希硫酸と反応して、水素を発生します。
Sn + H2SO4 → SnSO4 + H2
8 〇 銅は塩酸や希硫酸などには溶けませんが、酸化力のある希硝酸には溶けて一酸化窒素を発生します。
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
9 × 金は熱濃硫酸と反応しません。金は王水には溶けます。
実践問題
問1(2019本第2問問6)
酸化と還元に関する記述として下線部に誤りを含むものを、次の①~④のうちから一つ選べ。
① 臭素と水素が反応して臭化水素が生成するとき、臭素原子の酸化数は増加する。
② 希硫酸を電気分解すると、水素イオンが還元されて、気体の水素が発生する。
③ ナトリウムが水と反応すると、ナトリウムが酸化されて、水酸化ナトリウムが生成する。
④ 鉛蓄電池の放電では、 PbO2 が還元され、硫酸イオンと反応して PbSO4 が生成する。
(2019年度センター試験 本試験 化学基礎 第2問問6 より引用)
正解を見る
正解 1
1 ×
この反応式は
Br2 + H2 → 2 HBr
臭素の酸化数は 0 → -1 であり、還元されています。
2 〇
陰極では
2 H+ + 2 e- → H2
の反応が起きています。
水素の酸化数は +1 → 0 であり、還元されています。
3 〇
この反応式は
2 Na + 2 H2O → 2 NaOH + H2
ナトリウムの酸化数は 0 → +1 であり、酸化されています。
4 〇
鉛蓄電池の放電時の正極の反応は
PbO2 + 4 H+ + SO42- + 2 e- → PbSO4 + 2 H2O
正極の Pb の酸化数は +4 → +2 であり、還元されています。
問2(2019追第1問問7)
酸化銅(Ⅱ)とポリエチレンを用いた次の実験を行った。この実験に関する次の問い( a ・ b )に答えよ。
実験 酸化銅(Ⅱ)の粉末と細かく切ったポリエチレンを試験管 A に入れ、図 1 のようにして十分に加熱したところ、試験管 A の内壁に水滴がついた。また、発生した気体を石灰水の入った試験管 B に導いたところ、石灰水が白く濁った。
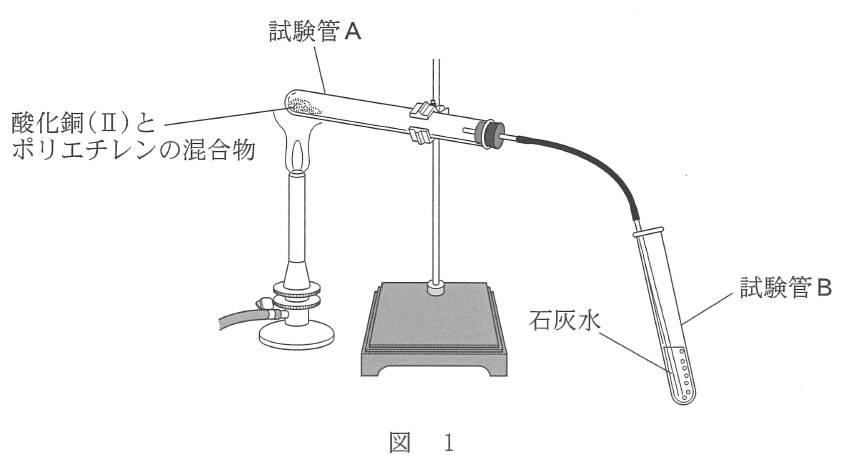
a 石灰水を白く濁らせる原因となった気体に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 水に溶かすと、その水溶液は塩基性を示す。
② 分子内の結合には極性がある。
③ 分子中に酸化数が + 4 の原子がある。
④ シュウ酸の酸化でも生成する。
b 試験管 A に入れた酸化銅(Ⅱ)は、すべて銅になった。得られた銅の質量が 0.32 g のとき、用いた酸化銅(Ⅱ)の質量は何 g か。最も適当な数値を、次の①~⑤のうちから一つ選べ。
① 0.24 g ② 0.36 g ③ 0.40 g ④ 0.48 g ⑤ 0.72 g
必要があれば、原子量は次の値を使うこと。
O 16 Cu 64
(2019年度センター試験 追試験 化学基礎 第1問問7 より引用)
正解を見る
正解 a 1 b 3
a
石灰水を白濁させる気体は二酸化炭素です。
石灰水には水酸化カルシウム Ca(OH)2 が溶けていて、CO2 と反応して水に溶けにくい炭酸カルシウム CaCO3 が生成します。
Ca(OH)2 + CO2 → CaCO3 + H2O
炭酸カルシウム CaCO3 が水に溶けにくいので、水溶液が白濁します。
1 × 二酸化炭素が溶けた炭酸水は弱酸性です。
2 〇 C = O 結合には極性があります。炭素原子が少し正電荷 δ+ 、酸素原子が少し負電荷 δ- をもちます。
3 〇 CO2 の炭素原子は、酸化数が +4 です。
4 〇 シュウ酸 H2C2O4 、(COOH)2 と書いてもいいです、の酸化では
H2C2O4 → 2 CO2 + 2 H+ + 2 e-
という半反応式になります。
b
実験結果から、酸化銅(Ⅱ)は還元されて銅となりました。
また、CH2 の構造が繰り返しているポリエチレンー(ーCH2ーCH2ー)nーは酸化され、水 H2O と二酸化炭素 CO2 が生成しました。
ポリエチレンが分解した生成物が還元剤としてはたらくと考えられます。
3 CuO + ( C + 2H ) → 3 Cu + CO2 + H2O
酸化銅(Ⅱ)と、ポリエチレンの分解物( C や H )が反応物です。銅 Cu と 石灰水を白濁させる二酸化炭素 CO2 と試験管内壁の水滴 H2O が生成物です。
試験管 A に入れた酸化銅(Ⅱ)は、すべて銅になりました。このとき、1 mol の酸化銅(Ⅱ)から 1 mol の銅が生成しています。
銅のモル質量は 64 g/mol なので、0.32 g の銅の物質量は
\(\frac{0.32[g]}{64[g/mol]}\) = 0.0050[mol]
酸化銅(Ⅱ)のモル質量は 80 g/mol ですから、求める質量は
80[g/mol] × 0.0050[mol] = 0.40[g]
問3(2016本第2問問6)
酸化還元反応を含まないものを、次の①~⑤のうちから一つ選べ。
① 硫酸で酸性にした赤紫色の過マンガン酸カリウム水溶液にシュウ酸水溶液を加えると、ほぼ無色の溶液になった。
② 常温の水にナトリウムを加えると、激しく反応して水素が発生した。
③ 銅線を空気中で加熱すると、表面が黒くなった。
④ 硝酸銀水溶液に食塩水を加えると、白色沈殿が生成した。
⑤ 硫酸で酸性にした無色のヨウ化カリウム水溶液に過酸化水素水を加えると、褐色の溶液となった。
(2016年度センター試験 本試験 化学基礎 第2問問6 より引用)
正解を見る
正解 4
1 〇 過マンガン酸カリウム水溶液が酸化剤として、シュウ酸が還元剤として酸化還元反応が起こります。この反応で、赤紫色の MnO4- がほぼ無色の Mn2+ となります。
過マンガン酸カリウムが酸化剤としてはたらきます。
半反応式は
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O ‥‥(A)
Mn の酸化数が +7 から +2 へ変化しています。過マンガン酸イオン MnO4- は赤紫色で、マンガン(Ⅱ)イオン Mn2+ はほぼ無色なので、酸化還元反応が進んだことがわかります。
シュウ酸は還元剤としてはたらきます。半反応式は
H2C2O4 → 2 CO2 + 2 H+ + 2 e- ‥‥(B)
C の酸化数が +3 から +4 へ変化しています。
反応式を完成させるには (A)式 × 2 と (B)式 × 5 を両辺足し合わせます。
2 MnO4- + 5 H2C2O4 + 6 H+ → 10 CO2 + 2 Mn2+ + 8 H2O
カリウムイオン( K+ を2個) と硫酸イオン( SO42- を3個) を両辺に加えて、電荷を中性にして完成です。
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 → 10 CO2 + 2 MnSO4 + 8 H2O + K2SO4
2 〇 Na が還元剤としてはたらきます。反応式は次のようになります。
2 Na + 2 H2O → 2 NaOH + H2
Na の酸化数は 0 → +1 に変化しています。
3 〇 銅が酸化されて酸化銅(Ⅱ)になっています。
2 Cu + O2 → 2 CuO
銅の酸化数は 0 → +2 です。
4 × 硝酸銀水溶液 AgNO3 の Ag+ イオンと、食塩水 NaCl の Cl- イオンが反応します。
塩化銀の沈殿では、酸化数の変化はありません。
Ag+ + Cl- → AgCl
5 〇 過酸化水素が酸化剤として、ヨウ化カリウムが還元剤としてはたらきます。
半反応式は
2 I- → I2 + 2 e-
H2O2 + 2 H+ + 2 e- → 2 H2O
半反応式の両辺を足し合わせると
H2O2 + 2 I- + 2 H+ → I2 + 2 H2O
カリウムイオン( K+ を2個)と、硫酸イオン( SO42- )を両辺に加えて、電気的に中性にすれば反応式は完成です。
H2O2 + 2 KI + H2SO4 → I2 + 2 H2O + K2SO4
生成物のヨウ素 I2 と水溶液中のヨウ化物イオン I- から、褐色の三ヨウ化物イオン I3- が生じます。




