酸化還元反応において、相手を酸化させる物質のことを酸化剤といいます。このとき、酸化剤自体は還元されます。
また、相手を還元させる物質のことを還元剤といいます。相手を還元させると、還元剤自体は酸化されます。
酸化剤・還元剤がどう変化するかは、覚える必要があります。
もくじ
酸化剤・還元剤
酸化還元反応において、相手を酸化させる物質のことを酸化剤といいます。また、相手を還元させる物質のことを還元剤といいます。
酸化・還元は電子の授受のことなので、酸化剤や還元剤を使うと、電子のやり取りが発生します。
酸化剤の特徴
酸化剤は相手を酸化させます。つまり、相手から電子を受け取ります(奪います)。相手から電子をもらうので、酸化剤自身は還元されます。
酸化剤が反応したときの特徴は、
- 相手を酸化させる
- 相手は電子を失い、酸化数が増加する
- 酸化剤自身は電子を受け取るので還元される
- 酸化剤の酸化数は減少する
となります。
還元剤の特徴
還元剤は相手を還元させます。つまり、相手に電子を与えます。相手に電子を渡すので、還元剤自身は電子を失い酸化されます。
還元剤が反応したときの特徴は、
- 相手を還元させる
- 相手は電子を受け取り、酸化数が減少する
- 還元剤自身は電子を失うので酸化される
- 還元剤の酸化数は増加する
となります。
代表的な酸化剤
酸化剤や還元剤を学ぶ理由は、最終的に酸化還元反応の化学反応式を書けるようになるためです。
いきなり酸化還元反応の化学反応式を書くのは難しいので、酸化剤や還元剤がどう反応するかをもとにして、式を組み立てていきます。
順序のとおりに進めばできますが、どうしても出発点の酸化剤と還元剤の反応については覚えなければなりません。
はじめからすべてを覚えるのは無理ですが、記憶できるように繰り返し練習しましょう。
代表的な酸化剤が、水溶液中で反応してどう変化するか表に示します。
| 酸化剤 | 反応 |
| 酸素 O2 | O2 ⇒ H2O |
| オゾン O3 | O3 ⇒ O2 + H2O |
| 塩素 Cl2 | Cl2 ⇒ 2 Cl- |
| 希硝酸 HNO3 | HNO3 ⇒ NO |
| 濃硝酸 HNO3 | HNO3 ⇒ NO2 |
| 熱濃硫酸 H2SO4 | H2SO4 ⇒ SO2 |
| 酸化マンガン(Ⅳ) MnO2 | MnO2 ⇒ Mn2+ |
| 過マンガン酸カリウム KMnO4 (注1) | MnO4- ⇒ Mn2+ |
| 二クロム酸カリウム K2Cr2O7 (注2) | Cr2O72- ⇒ 2 Cr3+ |
(注1:酸性の水溶液で起こる反応です。また K は酸化還元反応に関与しないので、省略しています。)
(注2:K は酸化還元反応に関与しないので、省略しています。)
例えば、酸素 O2 が酸化剤としてはたらいたら、反応後は水 H2O になるのだな、と覚えておきます。
同様に、塩素 Cl2 が酸化剤としてはたらくと反応後は塩化物イオン Clー になる、希硝酸 HNO3 が酸化剤としてはたらくと反応後は一酸化窒素 NO になる、などと覚えます。
代表的な還元剤
代表的な還元剤を表にまとめました。
| 還元剤 | 反応 |
| ナトリウム Na | Na ⇒ Na+ |
| ヨウ化物イオン 2 I- | 2 I- ⇒ I2 |
| 水素 H2 | H2 ⇒ 2 H+ |
| 鉄(Ⅱ)イオン Fe2+ | Fe2+ ⇒ Fe3+ |
| スズ(Ⅱ)イオン Sn2+ | Sn2+ ⇒ Sn4+ |
| シュウ酸 (COOH)2 | (COOH)2 ⇒ 2 CO2 |
| 硫化水素 H2S | H2S ⇒ S |
例えば、ヨウ化物イオン I- が還元剤としてはたらくと、反応後にヨウ素 I2 となります。
同様に、硫化水素 H2S が還元剤としてはたらくと、反応後に硫黄 S の単体になるのだな、などと覚えておきます。
酸化剤にも還元剤にもなる物質
代表的な酸化剤と還元剤を覚えたら終わり、だといいのですが、少し例外があります。酸化剤としても還元剤としてもはたらく物質があります。
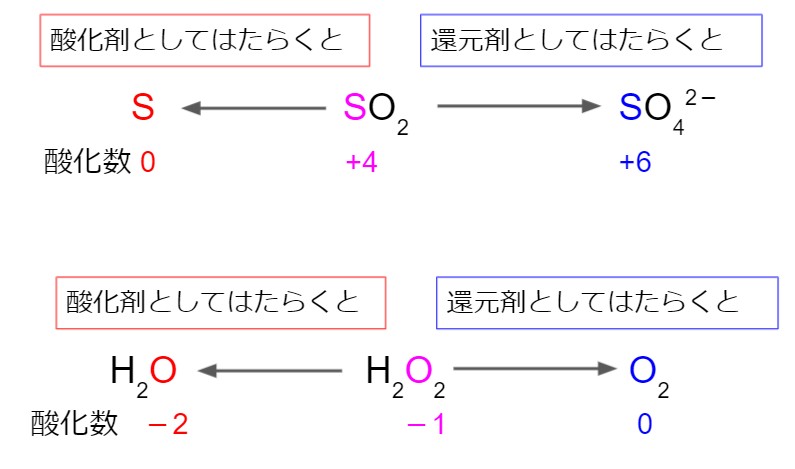
二酸化硫黄 SO2 と過酸化水素 H2O2 は、酸化剤・還元剤どちらにもなります。
これらは反応する相手によって、酸化剤になったり還元剤になったりします。
二酸化硫黄 SO2
二酸化硫黄が酸化剤としてはたらくときは、反応後に硫黄 S の単体になります。(酸化剤のとき SO2 ⇒ S)
二酸化硫黄が還元剤としてはたらくときは、反応後に硫酸イオン SO42- になります。(還元剤のとき SO2 ⇒ SO42-)
過酸化水素 H2O2
過酸化水素が酸化剤としてはたらくときは、反応後に水 H2O になります。(酸化剤のとき H2O2 ⇒ H2O)
過酸化水素が還元剤としてはたらくときは、反応後に酸素 O2 になります。(還元剤のとき H2O2 ⇒ O2)
問題演習
確認テスト1
次の空欄に当てはまる適切な語句を考えましょう。
酸化剤とは、反応の相手を酸化させて自身は( A 酸化・還元 )される物質です。また還元剤とは、反応の相手を( B 酸化・還元 )させて自身は( C 酸化・還元 )される物質です。
塩素、オゾン、硝酸、熱濃硫酸、過マンガン酸カリウムなどは( D 酸化・還元 )剤として使われます。
酸化還元反応後、塩素は( E )に、希硝酸は( F )に、濃硝酸は( G )に、熱濃硫酸は( H )に変化します。
また、酸性溶液中で過マンガン酸カリウムは( I )に、二クロム酸カリウムは( J )に変化します。
ナトリウムなどの金属の単体、ヨウ化物イオン、鉄(Ⅱ)イオン、スズ(Ⅱ)イオン、硫化水素などは( K 酸化・還元 )剤として使われます。
酸化還元反応後、ヨウ化物イオンは( L )に、鉄(Ⅱ)イオンは( M )に、硫化水素は( N )に変化します。
酸化剤にも還元剤にもなる物質として、過酸化水素や二酸化硫黄があります。
過酸化水素が酸化剤としてはたらくと( O )に、還元剤としてはたらくと( P )に変化します。
二酸化硫黄が酸化剤としてはたらくと( Q )に、還元剤としてはたらくと( R )に変化します。
実践問題1(2018追第2問問6)
酸化還元反応に関する記述として誤りを含むものを、次の①~④のうちから一つ選べ。
① 酸化還元反応では、必ず酸素原子または水素原子が関与する。
② オゾンは、酸化剤としてはたらく。
③ シュウ酸は、還元剤としてはたらく。
④ 二酸化硫黄は、反応する相手によって酸化剤としても還元剤としてもはたらく。
(2018年度センター試験 追試験 化学基礎 第2問問6 より引用)
