酸化剤・還元剤と、それらが反応後に変化する物質を覚えます。それをもとに、半反応式を書きます。
半反応式は、両辺の電荷と原子数をそろえると完成します。
もくじ
半反応式
前の項目で酸化剤と還元剤について学びました。何が酸化剤・還元剤で、反応後にどのような物質に変化するのかを覚えました。
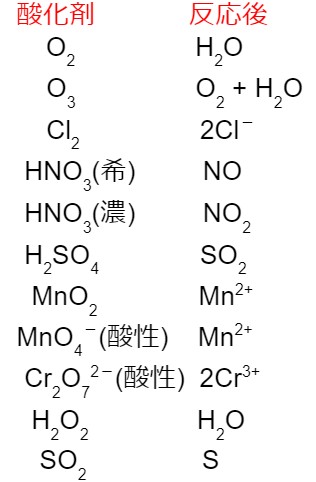
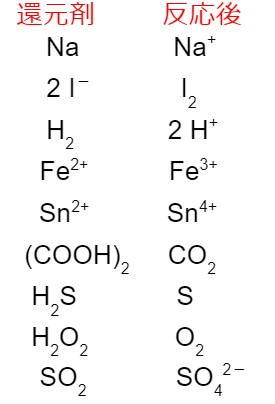
次に学ぶのは、半反応式です。
半反応式とは、酸化剤が相手を酸化させるためにする反応や、還元剤が相手を還元させるためにする反応を表した式です。
酸化と還元は表裏一体の関係です。酸化された物質があるなら、それに対応して還元された物質が存在しています。
しかし酸化還元反応をすぐに書くのは難しいので、酸化還元反応の化学反応式を組み立てる準備として、ひとまず酸化の反応と還元の反応を別々に書きます。
これらの式は酸化還元の半分なので、半反応式といいます。
半反応式の目標は、反応前後の左辺と右辺で、電荷をつり合わせることと、各原子の数を等しくすることです。
半反応式の書き方
半反応式は、酸化剤(還元剤)と、それがどう変化するかを覚えていると書けます。書き方の手順は、
① 酸化剤(還元剤)を左辺に、変化した物質を右辺に書く。
② 酸化数の変化の分だけ、電子 e- を移動させる。
③ 両辺の電荷をつり合わせるため、水素イオン H+ を加える。
④ 各原子の数を等しくするため、水 H2O を加える。
です。
例1.希硝酸
では、希硝酸 HNO3 が酸化剤としてはたらき、NO が発生する半反応式を書きましょう。
① 酸化剤 HNO3 は左辺、変化して生成する NO が右辺です。
HNO3 → NO
② HNO3 の窒素原子 N の酸化数は +5 です。NO の窒素原子 N の酸化数は +2 なので、酸化数は 3 減少しました。
酸化数が 3 減少したということは、電子を 3 個受け取り、還元されたということです。そこで左辺に電子を 3 個加えます。
HNO3 + 3 e- → NO
③ 左辺の電荷の和は -3 で、右辺の電荷の和は 0 (中性)です。両辺の電荷をつり合わせるため、左辺に H+ を 3 個加えます。
HNO3 + 3 H+ + 3 e- → NO
④ 左辺と右辺の原子の数を比べると、左辺の方が水素原子 H が 4 個、酸素原子 O が 2 個多いことがわかります。
両辺の各原子の数を等しくするため、右辺に H2O を 2 個加えます。
HNO3 + 3 H+ + 3 e- → NO + 2 H2O
これで希硝酸 HNO3 の半反応式が完成しました。
例2.塩素
塩素 Cl2 が酸化剤としてはたらき、塩化物イオン Cl- が生成する半反応式を書きましょう。
① 酸化剤の塩素 Cl2 は左辺に、発生する Cl- は右辺に書きます。
Cl2 → 2 Cl-
左辺に塩素原子が 2 個あるので、原子の数がつり合うように、はじめから右辺の塩化物イオンも 2 個にしておきます。
② 左辺の Cl の酸化数は 0 で、右辺の Cl の酸化数は -1 です。
Cl 1 個あたり、酸化数が 1 減少しているので、電子を 1 個受け取って還元されています。Cl が 2 個あるので、左辺に電子を 2 個加えます。
Cl2 + 2 e- → 2 Cl-
③ 左辺の電荷の和は -2 で、右辺の電荷の和は -2 です。つり合っているので、H+ は加えません。
④ 左辺と右辺で原子の数は等しくなっています。そこでこのまま、半反応式が完成しました。
Cl2 + 2 e- → 2 Cl-
例3.硫化水素
硫化水素 H2S が還元剤としてはたらき、S が発生する半反応式を書きましょう。
① 還元剤 H2S は左辺、変化して生成する S が右辺です。
H2S → S
② H2S の硫黄原子 S の酸化数は -2 です。右辺の硫黄の単体 S の酸化数は 0 なので、酸化数は 2 増加しました。
酸化数が 2 増加したということは、電子を 2 個失い、酸化されたということです。電子が 2 個放出されたので、右辺に電子を 2 個書きます。
H2S → S + 2 e-
③ 左辺の電荷の和は 0 で、右辺の電荷の和は -2 です。両辺の電荷をつり合わせるため、右辺に H+ を 2 個加えます。
H2S → S + 2 H+ + 2 e-
④ 左辺と右辺の各原子の数を比べると、すでに等しいです。そこで、硫化水素 H2S の半反応式が完成しました。
H2S → S + 2 H+ + 2 e-
例4.過マンガン酸カリウム
過マンガン酸カリウム KMnO4 が酸化剤としてはたらき、Mn2+ が生成する半反応式を書きましょう。
① 酸化剤の過マンガン酸カリウム KMnO4 は左辺に、発生する Mn2+ は右辺に書きます。K は反応に関与しないので省略します。
MnO4- → Mn2+
② 左辺の Mn の酸化数は +7 で、右辺の Mn の酸化数は +2 です。
酸化数が 5 減少しているので、電子を 5 個受け取って還元されています。左辺に電子を 5 個加えます。
MnO4- + 5 e- → Mn2+
③ 左辺の電荷の和は -6 で、右辺の電荷の和は +2 です。両辺の電荷をつり合わせるため、左辺に H+ を 8 個加えます。
MnO4- + 8 H+ + 5 e- → Mn2+
④ 左辺と右辺の原子の数を比べると、左辺の方が水素原子 H が 8 個、酸素原子 O が 4 個多いことがわかります。
両辺の各原子の数を等しくするため、右辺に H2O を 4 個加えます。
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
これで過マンガン酸カリウム KMnO4 の半反応式が完成しました。
例5.過酸化水素(還元剤)
過酸化水素 H2O2 が還元剤としてはたらき、O2 が発生する半反応式を書きましょう。
① 還元剤 H2O2 は左辺、変化して生成する O2 が右辺です。
H2O2 → O2
② H2O2 の酸素原子 O の酸化数は -1 です。右辺の酸素 O の酸化数は 0 なので、酸化数は 1 増加しました。
酸化数が 1 増加したということは、電子を 1 個失い、酸化されたということです。
過酸化水素 H2O2 には酸素原子 O が 2 個あります。電子が 2 個放出されたので、右辺に電子を 2 個書きます。
H2O2 → O2 + 2 e-
③ 左辺の電荷の和は 0 で、右辺の電荷の和は -2 です。両辺の電荷をつり合わせるため、右辺に H+ を 2 個加えます。
H2O2 → O2 + 2 H+ + 2 e-
④ 左辺と右辺の各原子の数を比べると、すでに等しいです。そこで、過酸化水素 H2O2 (還元剤)の半反応式が完成しました。
H2O2 → O2 + 2 H+ + 2 e-
半反応式の書き方(その2)
本質的な違いはありませんが、半反応式には別の書き方もあります。
① 酸化剤(還元剤)を左辺に、変化した物質を右辺に書く。
② 両辺の酸素原子 O の数を等しくするため、水 H2O を加える。
③ 両辺の水素原子 H の数を等しくするため、水素イオン H+ を加える。
④ 両辺の電荷をつり合わせるため、電子 e- を加える。
以下の例は練習のために、その2の書き方で行います。
例6.酸素
酸素 O2 が酸化剤としてはたらき、H2O が発生する半反応式を書きましょう。
① 酸化剤の O2 は左辺、変化して生成する H2O が右辺です。
O2 → H2O
② 両辺の酸素原子 O の数を等しくするため、右辺に H2O を加えます。
O2 → H2O + H2O
つまり O2 → 2 H2O
③ 両辺の水素原子 H の数を等しくするため、左辺に H+ を 4 個加えます。
O2 + 4 H+ → 2 H2O
④ 両辺の電荷をつり合わせるため、左辺に電子 e- を 4 個加えます。
O2 + 4 H+ + 4 e- → 2 H2O
これで酸素の半反応式は完成しました。
例7.ナトリウム
ナトリウム Na が還元剤としてはたらき、Na+ が発生する半反応式を書きましょう。
① 還元剤のナトリウム Na は左辺、変化して生成する Na+ が右辺です。
Na → Na+
② 両辺の酸素原子 O の数を比べますが、すでに等しいです。
Na → Na+
③ 両辺の水素原子 H の数を比べますが、すでに等しいです。
Na → Na+
④ 両辺の電荷をつり合わせるため、右辺に電子 e- を 1 個加えます。
Na → Na+ + e-
これでナトリウムの半反応式は完成しました。
例8.オゾン
オゾン O3 が酸化剤としてはたらき、O2 と H2O が発生する半反応式を書きましょう。
① 酸化剤のオゾン O3 は左辺、変化して生成する O2 と H2O が右辺です。
O3 → O2 + H2O
② 両辺の酸素原子 O の数を比べますが、すでに等しいです。
O3 → O2 + H2O
③ 両辺の水素原子 H の数を等しくするため、左辺に H+ を 2 個加えます。
O3 + 2 H+ → O2 + H2O
④ 両辺の電荷をつり合わせるため、左辺に電子 e- を 2 個加えます。
O3 + 2 H+ + 2 e- → O2 + H2O
これでオゾンの半反応式は完成しました。
例9.ヨウ化物イオン
ヨウ化物イオン I- が還元剤としてはたらき、I2 が発生する半反応式を書きましょう。
(還元剤としてヨウ化カリウム KI が使われることがありますが、K は反応に関与しないので I- として考えます。)
① 還元剤のヨウ化物イオン I- は左辺、変化して生成する I2 が右辺です。ヨウ素 I2 のヨウ素原子は 2 個なので、原子の数を合わせるため、左辺のヨウ化物イオンは 2 個とします。
2 I- → I2
② 両辺の酸素原子 O の数を比べますが、すでに等しいです。
2 I- → I2
③ 両辺の水素原子 H の数を比べますが、すでに等しいです。
2 I- → I2
④ 両辺の電荷をつり合わせるため、右辺に電子 e- を 2 個加えます。
2 I- → I2 + 2 e-
これでヨウ化物イオンの半反応式は完成しました。
例10.水素
水素 H2 が還元剤としてはたらき、H+ が発生する半反応式を書きましょう。
① 還元剤の水素 H2 は左辺、変化して生成する H+ が右辺です。水素 H2 の水素原子は 2 個なので、原子の数を合わせるため、右辺の水素イオンは 2 個とします。
H2 → 2 H+
② 両辺の酸素原子 O の数を比べますが、すでに等しいです。
H2 → 2 H+
③ 両辺の水素原子 H の数を比べますが、すでに等しいです。
H2 → 2 H+
④ 両辺の電荷をつり合わせるため、右辺に電子 e- を 2 個加えます。
H2 → 2 H+ + 2 e-
これで水素の半反応式は完成しました。
問題演習
確認テスト1
次の酸化剤・還元剤の半反応式を書いてみましょう。
- 鉄(Ⅱ)イオン Fe2+
- 濃硝酸 HNO3
- スズ(Ⅱ)イオン Sn2+
- 熱濃硫酸 H2SO4
- シュウ酸 (COOH)2
- 酸化マンガン(Ⅳ) MnO2
- 二クロム酸カリウム K2Cr2O7
- 過酸化水素 H2O2 (酸化剤として)
- 二酸化硫黄 SO2 (酸化剤として)
- 二酸化硫黄 SO2 (還元剤として)
