酸化還元反応式をつくるには、酸化の半反応式と還元の半反応式を組み合わせます。
酸化還元反応式のつくり方
① 酸化と還元の半反応式を書く。
② 2 つの半反応式で受け渡す電子の数を合わせて、式から消去する。
③ 水溶液中にあるイオンを化学反応式に書き加えて、反応式を電気的に中性にする。
もくじ
酸化還元反応式
酸化還元反応において化学反応式をつくるとき、酸化反応の半反応式と還元反応の半反応式を組み合わせます。
酸化と還元は電子の受け渡しのことです。酸化反応で電子を失い、還元反応で電子を受け取ります。
酸化と還元は一組として同時に起こるので、酸化反応で失う電子の数と、還元反応で受け取る電子の数は等しいです。
したがって、酸化の半反応式で失う電子の数と、還元の半反応式で受け取る電子の数をつり合わせれば、この 2 つの半反応式を 1 つにまとめることができます。
この 1 つにまとめた式が、つくりたい化学反応式の骨格になります。この式ができれば、酸化還元反応の化学反応式は、あと一歩で完成です。
あとは正しい化学反応式になるように、両辺を整えます。
化学反応式では、電荷をもつイオン式ではなく電気的に中性な化学式で表したいので、イオン式の物質を電気的に中性になるようにします。
酸化還元反応には関与しないが、水溶液中に存在しているイオンがあります。これらを反応式に形式的に書き加えることで、イオン式を化学式に書き換えます。
この手直しをすると、酸化還元反応の化学反応式は完成です。
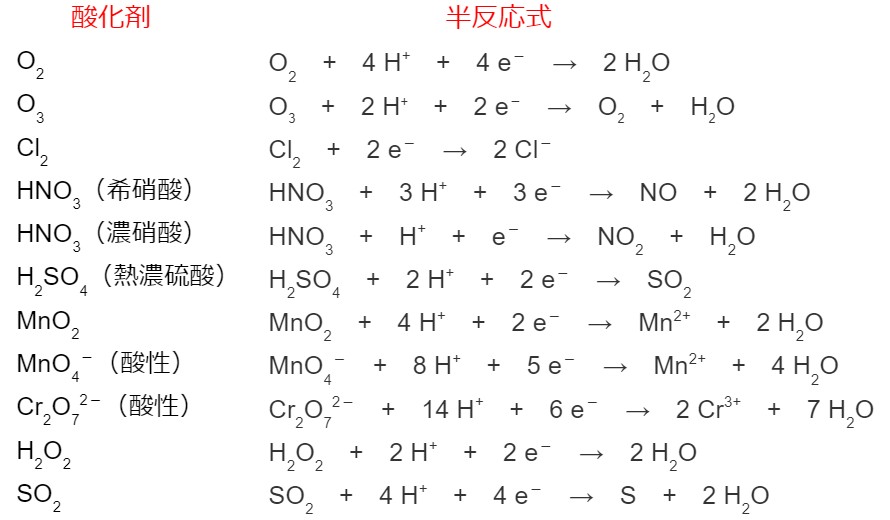
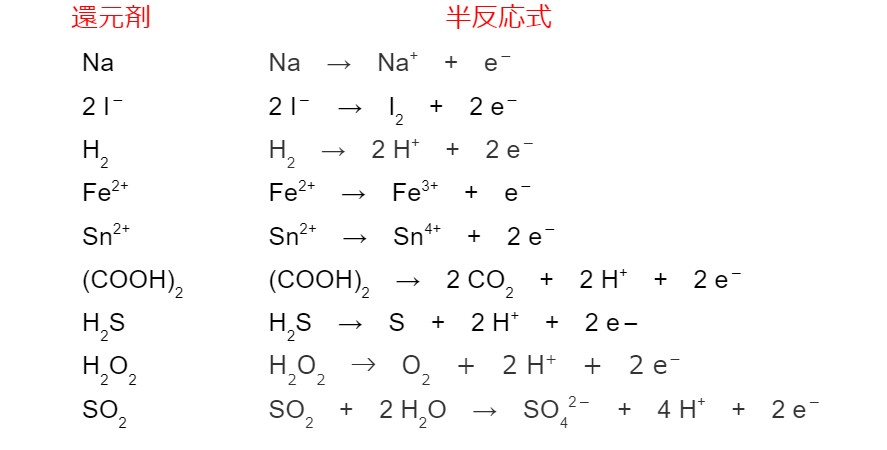
半反応式のまとめ
前の項目で半反応式の書き方を学びました。ここで半反応式をまとめておきます。
酸化還元反応式のつくり方
酸化還元反応式のつくり方は、以下のように大きく 3 つの作業に分かれます。
① 酸化と還元の半反応式を書く。
② 2 つの半反応式で受け渡す電子の数を合わせて、式から消去する。
③ 水溶液中にあるイオンを化学反応式に書き加えて、反応式を電気的に中性にする。
酸化還元反応式をつくる例として、過マンガン酸カリウム KMnO4 とヨウ化カリウム KI の反応を考えます。
過マンガン酸カリウムが酸化剤で、ヨウ化カリウムが還元剤です。またこの水溶液には硫酸が含まれており、酸性の条件下で行います。
① 半反応式を書く
酸化還元反応式をつくるため、まず酸化の半反応式と還元の半反応式を書きます。上で半反応式をまとめてあります。
過マンガン酸カリウムとヨウ化カリウムの半反応式を書きます。
MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
2 I- → I2 + 2 e-
過マンガン酸カリウムもヨウ化カリウムも、半反応式の段階では反応に関わるイオンだけ書かれています。( MnO4- と I- )
② 電子 e- を消去する
酸化と還元の反応は表と裏の関係です。酸化が起これば、その裏で必ず還元が起こっています。
そのため酸化で失われる電子 e- の数と、還元で得られる電子 e- の数は等しいです。
そこで、2 つの半反応式で受け渡される電子の数を揃えて、2 つの式を足し合わせ e- を消去します。
MnO4- の半反応式を 2 倍、I- の半反応式を 5 倍して、この 2 式を足し合わせます。
2 MnO4- + 16 H+ + 10 e- → 2 Mn2+ + 8 H2O
10 I- → 5 I2 + 10 e-
左辺と右辺から 10 e- が消えるので、
2 MnO4- + 16 H+ + 10 I- → 2 Mn2+ + 8 H2O + 5 I2
これで化学反応式の骨格ができました。
③ イオンを電気的に中性にする
②でできた式を、形式的に整えます。イオン式から電気的に中性な化学式にしていきます。
酸化還元反応には関与しないものの、水溶液中に存在しているイオンがあります。これらを書き加えることで、イオン式を電気的に中性な化学式に書き換えます。
ここで例として考えている水溶液には、硫酸 H2SO4 と過マンガン酸カリウム KMnO4 とヨウ化カリウム KI が含まれています。
②で作った式
2 MnO4- + 16 H+ + 10 I- → 2 Mn2+ + 8 H2O + 5 I2
で書かれていないが、水溶液中に含まれるイオンは、SO42- と K+ です。
そこで SO42- と K+ を式に加えて、電荷を中性にします。
左辺の『 2 MnO4- + 16 H+ + 10 I- 』を電気的に中性にするために、K+ は 12 個、SO42- は 8 個必要です。
K+ を 12 個、SO42- を 8 個左辺に加えると、『 2 KMnO4 + 8 H2SO4 + 10 KI 』になります。
右辺にも K+ を 12 個、SO42- を 8 個加えないと、両辺はつり合いません。
右辺の『 2 Mn2+ + 8 H2O + 5 I2 』に K+ を 12 個、SO42- を 8 個加えると、
『 2 MnSO4 + 8 H2O + 5 I2 + 6 K2SO4 』になります。
これで両辺の電荷はそれぞれ中性になり、酸化還元反応式が完成しました。
2 KMnO4 + 8 H2SO4 + 10 KI → 2 MnSO4 + 8 H2O + 5 I2 + 6 K2SO4
問題演習
確認テスト1
硫酸で酸性にした過マンガン酸カリウム水溶液を、過酸化水素水に加えたときの酸化還元反応式を書きましょう。
実践問題1(2017本第2問問6)
MnO4- は、中性または塩基性水溶液中では酸化剤としてはたらき、次の反応式のように、ある 2 価の金属イオン M2+ を酸化することができる。
MnO4- + a H2O + b e- → MnO2 + 2 a OH-
M2+ → M3+ + e-
これらの反応式から電子 e- を消去すると、反応全体は次のように表される。
MnO4- + c M2+ + a H2O → MnO2 + c M3+ + 2 a OH-
これらの反応式の係数 b と c の組合せとして正しいものを、次の①~⑥のうちから一つ選べ。
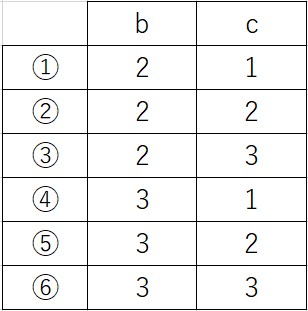
(2017年度センター試験 本試験 化学基礎 第2問問6 より引用)
