水溶液中で金属の単体が陽イオンになろうとする性質を、金属のイオン化傾向といいます。
陽イオンになりやすい(イオン化傾向の大きい)順に金属を並べたものを、イオン化列といいます。
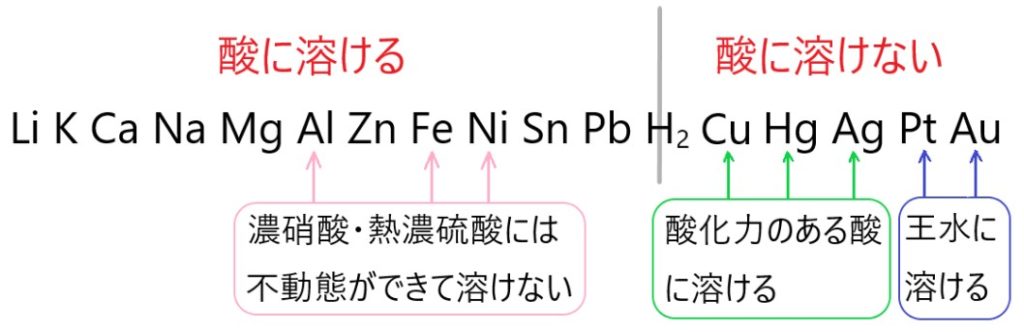
水素よりイオン化傾向の大きな金属は、一般に酸に溶けて気体の H2 が発生します。
Al 、Fe 、Ni は表面に酸化被膜ができるため、酸化力のある濃硝酸や熱濃硫酸に溶けません。この状態を不動態といいます。
Cu 、Hg 、Ag は酸に溶けませんが、硝酸や熱濃硫酸のような酸化力のある酸には溶けます。
Pt 、Au は王水だけに溶けます。
もくじ
イオン化傾向
水溶液中で金属の単体が電子を放出して陽イオンになろうとする性質を、金属のイオン化傾向といいます。
陽イオンになりやすい金属を、イオン化傾向が大きい金属といいます。
水溶液中に複数の金属の単体や金属イオンがあるとき、どのような反応をするか考えるのにイオン化傾向は役立ちます。
そこで各金属のあいだで、どちらがイオン化傾向が大きいかを比べると便利です。
陽イオンになりやすい(イオン化傾向の大きい)順に金属を並べたものを、イオン化列といいます。

イオン化傾向が大きい金属から、リチウム、カリウム、カルシウム、ナトリウム、マグネシウム、アルミニウム、亜鉛、鉄、ニッケル、スズ、鉛、(水素)、銅、水銀、銀、白金、金と並びます。
途中にある水素 H2 は金属でないものの、水溶液中にある水素イオン H+ と各金属のどちらが陽イオンになりやすいかを比べられるので、イオン化列に含んでいます。
イオン化列を覚えるのに、「リッチだな、かりるかな、まあ、あてにすんな、ひどすぎるしゃっきん」という、昔からある語呂合わせがとても有効です。
元素記号と、金属の名称の頭文字がだいたい合っているので、非常に覚えやすく実用的です。
では具体的に、金属のイオン化傾向で何がわかるか見てみましょう。
硫酸銅(Ⅱ)水溶液 CuSO4 に、亜鉛の板を入れたときの反応を考えましょう。
このとき水溶液中には、銅(Ⅱ)イオン Cu2+ と硫酸イオン SO42- 、亜鉛の単体 Zn が存在しています。さらにこの水溶液は弱酸性なので、水素イオン H+ や水酸化物イオン OHー もあります。
反応で重要なのは Cu2+ と Zn です。
銅 Cu と亜鉛 Zn のイオン化傾向を比べると、Zn のイオン化傾向がより大きいです。そのため、Zn の方が陽イオンになりやすいです。
はじめの水溶液では、Cu が陽イオン Cu2+ であり、Zn は金属の単体として存在しています。そこで、Cu が金属の単体になり、Zn が陽イオンの Zn2+ になるという反応が起こります。

Zn の板は CuSO4 水溶液中で溶けて、亜鉛イオン Zn2+ になります。これは電子を失うので、酸化反応です。
Zn → Zn2+ + 2 e-
逆に水溶液中の銅イオン Cu2+ は、イオン化傾向がより大きい Zn が陽イオンになるので、Zn から電子を受け取って Cu になります。
Cu は Zn の板の表面に、固体として付着します。Cu2+ が電子を受け取るので、還元反応です。
Cu2+ + 2 e- → Cu
イオン化傾向と酸との反応
イオン化傾向が大きい金属は、電子を失いやすく酸化されやすい性質です。イオン化傾向が大きい方が、反応性が大きいといえます。
そこで、イオン化列を見ながら、酸との反応性を考えます。

イオン化列では、鉛 Pb と銅 Cu のあいだに水素 H2 が入っています。
これより、Pb から Li までのイオン化傾向が大きい金属は、H より陽イオンになりやすいと考えられます。
つまり Pb から Li までの金属は、酸である水素イオン H+ が同じ水溶液に存在したとき、H+ に電子を与えて自分が陽イオンになります。
そこで(少し例外はあるものの)、一般に、イオン化傾向が Li から Pb までの金属は、酸に溶けるといえます。
逆に H2 よりイオン化傾向が小さい Cu から Au までの金属は、酸である水素イオン H+ が同じ水溶液に存在しても、陽イオンにはなりません。
そこで(少し例外はあるものの)、一般に、イオン化傾向が Cu から Au までの金属は、酸に溶けないといえます。

酸に溶けると水素 H2 が発生
H2 よりイオン化傾向が大きい金属が酸に溶ける場合、H+ に電子を与えて酸化されるという反応が起こります。
そのため、金属が溶けて発生する気体は水素 H2 です。
例えば、アルミニウム Al が塩酸に溶けたとき、水素 H2 が発生します。Al が電子を放出して陽イオンとなり、H+ が電子を受け取って気体の H2 になります。
Al → Al3+ + 3 e-
2 H+ + 2 e- → H2
両式をまとめて整理すると
2 Al + 6 H+ → 2 Al3+ + 3 H2
塩酸に溶かしているので、化学反応式を完成させると以下のようになります。
2 Al + 6 HCl → 2 AlCl3 + 3 H2
Al、Fe、Ni は不動態をつくる
H2 よりイオン化傾向の大きい金属は酸に溶けます。しかし例外として、アルミニウム Al と鉄 Fe 、ニッケル Ni は、濃硝酸や熱濃硫酸には溶けません。
濃硝酸や熱濃硫酸は酸化力が強いので、Al 、Fe 、Ni と接触すると、金属表面に緻密な酸化被膜が生じます。そのため、それ以上反応が進まなくなり、表面が酸化されるだけで溶けません。
このように、表面に酸化物の被膜ができて、内部の金属が保護される状態を不動態といいます。
酸化力のある酸に溶ける
H2 よりイオン化傾向の小さい金属は酸に溶けません。しかし例外として、銅 Cu と水銀 Hg 、銀 Ag は、硝酸や熱濃硫酸のような酸化力のある酸に溶けます。
またこのとき、金属が溶けても発生する気体は H2 ではありません。Cu や Hg 、Ag が溶ける反応は酸化還元反応です。
そのため発生する気体は、酸化剤である酸の半反応式で発生する気体になります。
詳しくは「化学基礎 半反応式」の項目を参照してください。反応した酸が希硝酸ならば発生する気体は一酸化窒素 NO 、濃硝酸ならば二酸化窒素 NO2 、熱濃硫酸ならば二酸化硫黄 SO2 です。
復習として、Cu を熱濃硫酸 H2SO4 で溶かしてみましょう。
Cu が電子を放出して陽イオンとなるときの半反応式は、
Cu → Cu2+ + 2 e-
熱濃硫酸が酸化剤となるときの半反応式は、
H2SO4 + 2 H+ + 2 e- → SO2 + 2 H2O
2 つの半反応式を足し合わせると電子が消去できるので、
Cu + H2SO4 + 2 H+ → Cu2+ + SO2 + 2 H2O ‥‥(*)
(*)式の両辺に 1 個の SO42- を加えると、酸化還元反応式が完成します。
Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O
以上のように、Cu は酸化力のある酸である、熱濃硫酸に溶けます。溶けたときに発生する気体は SO2 です。
王水に溶ける
白金 Pt と金 Au は、王水に溶けます。
王水は、濃硝酸と濃塩酸を体積比 1:3 で混合した、非常に酸化力の強い酸です。
イオン化傾向と酸との反応のまとめは、以下の通りです。
問題演習
確認テスト1
次の図は、金属をイオン化傾向の大きい順に並べたイオン化列です。

1. ア~エに入る金属名を考えましょう。
2. 次の文章は、ア~エの金属の特徴を記しています。どの金属に当てはまるか考えましょう。
A. 塩酸には溶けないが、濃硝酸には溶ける。
B. 塩酸には溶けるが、濃硝酸には溶けない。
C. 塩酸に溶けて、気体の H2 が発生する。
D. 酸には溶けないが、王水だけには溶ける。
確認テスト2
亜鉛 Zn を塩酸に入れると、気体を発生させながら溶けます。この化学反応式を考えましょう。
確認テスト3
銅 Cu を希硝酸に入れると、気体を発生させながら溶けます。この化学反応式を考えましょう。
実践問題1(2018追第2問問7)
金属 A と金属 B は、Au 、Cu 、Zn のいずれかである。A と B の金属板の表面をよく磨いて、金属イオンを含む水溶液にそれぞれ浸した。金属板の表面を観察したところ、表 1 のようになった。A と B の組合せとして最も適当なものを、下の①~⑥のうちから一つ選べ。ただし、金属をイオン化傾向の大きな順に並べた金属のイオン化列は、
Zn > Sn > Pb > Cu > Ag > Au
である。


(2018年度センター試験 追試験 化学基礎 第2問問7 より引用)
実践問題2(2020本第2問問6)
金属の溶解を伴う反応に関する記述として正しいものを、次の①~④のうちから一つ選べ。
① 硝酸銀水溶液に鉄くぎを入れると、鉄が溶け、銀が析出する。
② 硫酸銅(Ⅱ)水溶液に亜鉛板を入れると、亜鉛が溶け、水素が発生する。
③ 希硝酸に銅板を入れると、銅が溶け、水素が発生する。
④ 濃硝酸にアルミニウム板を入れると、アルミニウム板が溶け続ける。
(2020年度センター試験 本試験 化学基礎 第2問問6 より引用)
実践問題3(2016追第2問問7)
金属および金属イオンの反応性に関する記述として誤りを含むものを、次の①~⑤のうちから一つ選べ。
① 硫酸銅(Ⅱ)水溶液に亜鉛を浸すと銅が析出する。
② 塩化マグネシウム水溶液に鉄を浸すとマグネシウムが析出する。
③ 硝酸銀水溶液に銅を浸すと銀が析出する。
④ 塩酸に亜鉛を浸すと水素が発生する。
⑤ 白金は王水に溶ける。
(2016年度センター試験 追試験 化学基礎 第2問問7 より引用)
